Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Оксиды углеродаCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Оксиды углерода Оксиды углерода
Монооксид углерода СО.
Несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Молекула слабополярна, содержит ковалентную тройную σππ‑связь [:C≡O;]
, изоэлектронна молекуле N2. Термически устойчив. Малорастворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с кислородом и пероксидом натрия. С переходными металлами образует комплексные соединения без внешней сферы (карбонилы). Количественно реагирует с I2O5.
Качественная реакция – помутнение раствора хлорида палладия(II).
Применяется как реагент в органическом синтезе, промышленно важный восстановитель металлов из их руд.
Чрезвычайно ядовит, загрязняет атмосферу городов (продукт неполного сгорания моторного топлива). По тому же механизму, что и кислород, СО присоединяется к атому железа в гемоглобине крови, причем связывается более прочно и тем самым блокирует перенос кислорода в организме, вызывая сильное отравление и остановку дыхания; отсюда тривиальное название СО – угарный газ.
Уравнения важнейших реакций:
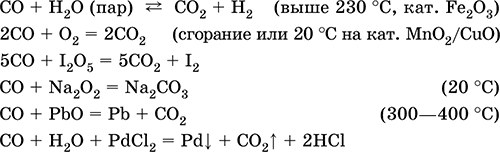
Получение в промышленности: сжигание кокса (см.) при недостатке кислорода, восстановление раскаленным коксом углекислого газа и водяного пара:
![]()
Диоксид углерода СO2.
Кислотный оксид. Техническое название – углекислый газ. Бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молекула неполярна, имеет линейное строение [С(O)2] (sр‑гибридизация), содержит ковалентные σπ‑связи С=O. Термически устойчив до температуры красного каления. При сжатии (давление = 50 атм) и охлаждении легко переходит в жидкое и твердое («сухой лед») состояния.
Твердый СO2 возгоняется уже при низких температурах. Мало растворим в воде (O,88 л/1 л Н2O при 20 °C); образует моногидрат, который медленно изомеризуется (на 0,4 %) в угольную кислоту. Реагирует со щелочами. Восстанавливается магнием и кальцием. Из воздуха удаляется при контакте с пероксидом натрия (одновременно регенерируется кислород).
Простейшая качественная реакция – угасание горящей древесной лучинки в атмосфере СO2.
Применяется в многотоннажных производствах соды, сахара и карбамида, в пищевой промышленности для газирования безалкогольных напитков и как хладагент.
Содержится в воздухе (0,03 % по объему), воде минеральных источников. Не поддерживает горение и дыхание. Ассимилируется зелеными растениями при фотосинтезе (с помощью хлорофилла и под воздействием солнечных лучей). Ядовит при содержании в воздухе свыше 15 % по объему.
Уравнения важнейших реакций:

Получение в промышленности– при полном сгорании кокса (см.) или при обжиге известняка:
СаСO3 = СаО + СO2
(900–1200 °C)
в лаборатории
– при обработке карбонатов (например, кусочков мрамора СаСO3) сильными кислотами:
СаСO3(т) + H2SO4 = CaSO4↓ + Н2O + CO2
↑
Смотрите также
Введение
Трудно переоценить значение крупномасштабного производства аренов для
химической промышленности и для всей экономики. Бензол и его производные
являются основным источником всех ароматических соедине ...
Разложение клетчатки микроорганизмами
Еще в
древности при построении деревянных судов для защиты дерева использовали
асфальт. Во времена Римской империи суда обивали металлическими листами. Выбор
материалов производился экспери ...
Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или
нескольких атомов, называются молекулами (реальными или условными
формульными единицами многоатомных веществ). Атомы в молекулах химически
связаны.
П ...


