Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Неметаллы VA‑группы. Азот. Аммиак.Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Неметаллы VA‑группы. Азот. Аммиак. Неметаллы VA‑группы. Азот. Аммиак.Страница 2
Весьма реакционноспособный, склонен к реакциям присоединения. Crорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N‑III) и окислительные (за счет НI) свойства. Осушается только оксидом кальция.
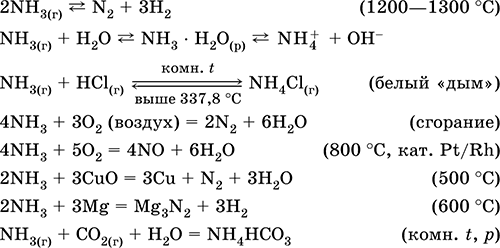
Качественные реакции – образование белого «дыма» при контакте с газообразным НCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
Получение: в лаборатории– вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + СаО):
![]()
или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности
аммиак синтезируют из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH3 Н2O.
Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и Н2O, связанные слабой водородной связью H3N… НОН. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4‑ и анион ОН‑). Катион аммония имеет правильно‑тетраэдрическое строение (sp3‑гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет NIII) в концентрированном растворе. Вступает в реакции ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным НCl.
Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1М растворе аммиака содержится в основном гидрат NH3 Н2O и лишь 0,4 % ионов NH4+ и ОН‑ (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате. Уравнения важнейших реакций:
NH3 Н2O (конц.) = NH3↑ + Н2O (кипячение с NaOH)
NH3 Н2O + НCl (разб.) = NH4Cl + Н2O
3(NH3 Н2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3NH4Cl
8(NH3 Н2O) (конц.) + ЗBr2(р) = N2↑ + 6NH4Br + 8Н2O (40–50 °C)
2(NH3 Н2O) (конц.) + 2КMnO4 = N2↑ + 2MnO2↓ + 4Н2O + 2КОН
4(NH3 Н2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 Н2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4Н2O
6(NH3 Н2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6Н2O
Разбавленный раствор аммиака (3–10 %‑ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5–25 %‑ный) – аммиачной водой (выпускается промышленностью).


