Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Уравнение изотермы химической реакции Вант-Гоффа.Статьи и работы по химии / Вычисление теплового эффекта реакций / Статьи и работы по химии / Вычисление теплового эффекта реакций / Уравнение изотермы химической реакции Вант-Гоффа. Уравнение изотермы химической реакции Вант-Гоффа.
В соответствии с законом действующих масс для произвольной реакции
а A + b B = c C + d D
уравнение скорости прямой реакции можно записать:
![]() ,
,
а для скорости обратной реакции: ![]() .
.
По мере протекания реакции слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости υ 1 и υ 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
![]() ,
,
Откуда Kc = k1 / k2 = ![]() .
.
Постоянная величина Кс, равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия. Константа равновесия является постоянной только для данной температуры, т.е.
Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции представляют собой смесь идеальных газов, то константа равновесия (Кр) выражается через парциальные давления компонентов:
Kp = ![]() .
.
Для перехода от Кр к Кс воспользуемся уравнением состояния P · V = n·R·T. Поскольку
![]() , то P = C·R·T.
, то P = C·R·T.
Тогда ![]() .
.
Из уравнения следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция протекает самопроизвольно при постоянных Р и Т или V и Т, то значения D G и D F этой реакции можно получить из уравнений:
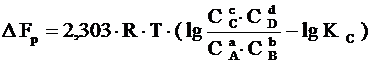 ,
,
где С А, С В, С С, С D – неравновесные концентрации исходных веществ и продуктов реакции.
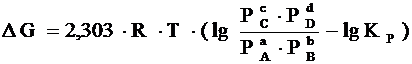 ,
,
где Р А, Р В, Р С, Р D – парциальные давления исходных веществ и продуктов реакции.
Два последних уравнения называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения D G и D F реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2 СО (г) = СО 2 (г) + С (т)
константа равновесия записывается в виде
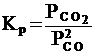 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1) выражается следующим уравнением Вант-Гоффа:
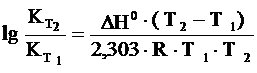 ,
,
где D Н0 – тепловой эффект реакции.
Для эндотермической реакции (реакция идет с поглощением тепла) константа равновесия увеличивается с повышением температуры, система как бы сопротивляется нагреванию.
Смотрите также
Аннотация
Методические
указания для подготовки и выполнения лабораторных по курсу
"Неорганическая химия" и "Общая химия" применительно ко
специальностям кроме юридических.
Авторы: ...
Полимерные нанокомпозиты на основе органомодифицированных слоистых силикатов: особенности структуры, получение, свойства
Полимерные
нанокомпозиты, представляют собой полимеры, наполненные наночастицами,
взаимодействующими с полимерной матрицей не на макро- (как в случае с
композиционными материалами), а на мо ...
Монокристаллический кремень
Основной объем
монокристаллического кремния (80-90%) потребляемого электронной
промышленностью, выращивается по методу Чохральского.
Фактически весь кремний,
используемый для производст ...


