Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Реакции обмена.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Реакции обмена. Реакции обмена.
Обязательным условием течения реакций между электролитами является удаление из раствора тех или иных ионов - например, вследствие образования слабо диссоциирующих веществ, или веществ, выделяющихся из раствора в виде осадка или газа. Иначе говоря, реакции в растворах электролитов всегда идут в сторону образования наименее растворимых веществ.
Уравнения реакций в таких случаях рекомендуется записывать в молекулярно-ионной форме, которая позволяет лучше понять сущность протекающих процессов. В молекулярно-ионных уравнениях сильные электролит пишутся в виде ионов, а слабые электролиты, трудно растворимые вещества - в виде молекул.
Существует четыре случая обменных реакций в растворах электролитов, равновесие которых сильно смещено в сторону образования продуктов реакции:
1. Реакции, идущие с образованием осадка.
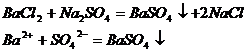
2. Реакции, сопровождающиеся образованием газообразных (летучих) веществ.
![]()
3. Реакции, протекающие с, образованием слабых электролитов.
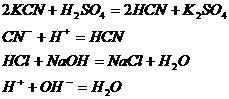
4. Реакции, идущие с образованием комплексных ионов.
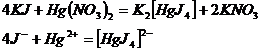
Смотрите также
Получение, свойства и применение амидо-аммониевой соли малеопимаровой кислоты на основе малеинизированной канифоли
Республика Беларусь
располагает обширной сырьевой базой для развития лесохимической промышленности.
Одним из видов такого сырья является канифоль, которую получают из живицы путем
отгонки с ...
Характеристика кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого
Kobold - домовой, гном. Соединения кобальта были известны и применялись в
глубокой древности. Сохранился египетский с ...
Характеристика сим–триазиновых пестицидов и их содержание в различных объектах окружающей среды
Возделываемые культуры обладают разной конкурентной способностью к сорнякам в борьбе за свет, влагу и питательные элементы. Чем больше экологические требования сорняков совпадают с требованиями ку ...


