Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №19.Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №19. Билет №19.Страница 1
Коррозия металлов (химическая и электрохимическая). Способы предупреждения коррозии.
Разрушение металлов и сплавов вследствие химического взаимодействия их с окружающей средой называются коррозией металлов.
Коррозию, вызванную непосредственным химическим взаимодействием между металлом и окружающей средой, называют химической коррозией.
Химическая коррозия — окисление металла без возникновения гальванической пары. Газовая коррозия — при t > 600°С:
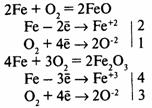
Коррозию, сопровождающуюся возникновением электрического тока за счет появления гальванической пары, называют электрохимической коррозией.
Электрохимическая коррозия – разрушение металла в электролите с возникновением гальванической пары.
![]() – ионы выходят в раствор, электроны перемещаются к менее активному металлу, например к меди.
– ионы выходят в раствор, электроны перемещаются к менее активному металлу, например к меди.
![]() – разряжаются на менее активном металле, например на меди.
– разряжаются на менее активном металле, например на меди.
Одним из наиболее широко распространенных видов электрохимической коррозии является ржавление обычной стали в водной среде и на воздухе. На поверхности металлических изделий всегда имеется пленка влаги, адсорбированной из воздуха. Она является электролитом, так как в ней растворены различные газы (СО2, SO2 и др.). Зерна карбида железа Fe3С химически менее активны, чем железо. Поэтому возникают микрогальваническис элементы: зерна Fe3С играют роль катодов, а зерна чистого железа — роль анодов. Железо разрушается — оно ржавеет. Протекающие при этом процессы весьма сложные. Укажем лишь суммарное уравнение реакции:
![]()
Ржавчина имеет неопределенный состав ![]()
Для защиты от коррозии металлов
широко используют лакокрасочные покрытия. Однако краски не вечны, изделия приходится перекрашивать. На это затрачивается ручной труд, расходуется много лакокрасочных материалов.
Из неметаллических покрытий для защиты стали и чугуна большое значение имеет эмаль. Эмаль — это силикатное стекло с добавками оксидов металлов. Ее наносят на поверхность материала в виде порошка и обжигают при 500—1000 °С.
Покрытия из эмалей обладают стойкостью по отношению к щелочам и кислотам, длительно противостоят атмосферной коррозии. Но эмаль легко разрушается при ударе. Благодаря термостойкости, декоративному виду, легкости очистки эмаль широко используется для покрытия изделий домашнего хозяйства и санитарной техники.
С целью защиты металлов от коррозии (и для декоративных целей) издавна используют металлические покрытия. Железо оцинковывают, лудят (покрывают оловом), покрывают никелем, хромируют и т. д.
Защитить металл от коррозии можно с помощью металла и другим способом. Например, если соединить железное изделие или сооружение проводником с куском более активного металла, например магния, то возникает гальванический элемент. При этом сооружение (железо) играет роль катода, а более активный металл выполняет роль анода. Анод разрушается, а катод — защищаемый металл — не изменяется. Такая защита называется протекторной.
Смотрите также
Результаты экспериментов
Таблица 3.4.
Экспериментальные
данные по окислительному карбонилированию фенилацетилена и метилацетилена.
Иссл.
система
Дата
Реагирующая система
...
Разновидности и принцип действия экстракторов
В ходе
химико-технологического процесса химическому превращению подвергаются
разнообразные вещества, обладающие различными физико-химическими свойствами.
Разнообразна и сама природа химичес ...


