Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория кристаллического поляОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Теория кристаллического поля Теория кристаллического поляСтраница 1
Теория кристаллического поля исходит из того, что природа лигандов и их расположение вокруг центрального иона (симметрия комплекса) уменьшают вырождение d-орбиталей и изменяют их энергию.
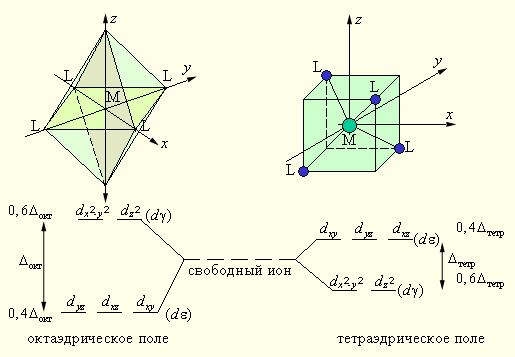
Рассмотрим это на примере комплексного иона октаэдрической симметрии [ML6]n+, в котором центральный атом имеет электронную конфигурацию d1. Ион Mn+ расположен в центре октаэдра, сoвпадающем с началом прямоугольной системы координат, а лиганды – в вершинах октаэдра, через которые проходят оси координат (x, y, z).
Орбитали dx²–y² и dz² совпадают с координатными осями, а остальные три (dxy, dxz, dyz) проходят вдоль биссектриc соответствующих координатных углов (рис. 9.5). B отсутствии лигандов все пять орбиталей были энергетически равноценны. Но с появлением лигандов в вершинах октаэдра электрон, находясь на орбиталях dx²–y² и dz², испытывает сильное отталкивание от отрицательно заряженных лигандов или от отрицательного конца полярной молекулы. Другие три орбитали попадают в области с минимальными значениями отрицательного потенциала, поэтому вероятность нахождения электрона на орбиталях dxy, dxz, dyz будет больше. Это соответствует тому, что под действием лигандов прежде энергетически равноценные d-орбитали разделились на две группы: орбитали dx²–y² и dz²(dγ)*), энергетически невыгодные для электрона, и орбитали dxy, dxz, dyz(dε)*) с меньшей энергией. Схема расщепления d-орбиталей октаэдрическим (тетраэдрическим) окружением показана на рис. 9.5.
Разность между dε и dγ-уровнями обозначается через Δокт (Δтетр) и называется параметром расщепления *).
*) В научной литературе орбитали обычно dγ и dε обозначают eg и t2g, а параметр расщепления 10Dq.
 |
|
Рисунок 9.5 Диаграмма расщепления d-орбиталей в поле лигандов |
Из рис. 9.5 следует, что заселение любой dε-орбитали одним электроном приводит к уменьшению на 0,4Δокт энергии октаэдрического комплекса, т. е. стабилизирует его по сравнению со свободным (сферически симметричным) ионом, а заселение электроном любой из dγ-орбиталей этот комплекс дестабилизирует на 0,6Δокт. В тетраэдрическом поле порядок расщепления d-орбиталей будет обратным, а потому энергия стабилизации на один электрон будет 0,6 Δтетр, а дестабилизации – 0,4 Δтетр.
Величина понижения энергии координационного соединения в результате перераспределения d-электронов по dε- и dγ-орбиталям называется энергией стабилизации кристаллическим полем (ЭСКП). Эта энергия зависит от числа электронов на dε- и dγ-орбиталях и вычисляется по формулам: l ЭСКПокт = (0,4n – 0,6m) Δокт,
l ЭСКПтетр = (0,6n – 0,4m) Δтетр,
где n – число электронов на нижнем подуровне, m – число электронов на верхнем подуровне.
Параметр расщепления в октаэдрическом поле больше, чем в тетраэдрическом, содержащем те же лиганды, и равен Δокт = 9/4 Δтетр
Параметр расщепления Δ зависит от размеров центрального иона, его заряда, электронной конфигурации и от природы лиганда (табл. 9.1). Экспериментально его определяют по спектрам поглощения комплексных соединений. Возбуждение электрона с нижнего уровня на верхний сопровождается поглощением энергии и появлением в спектре полосы, максимум которой соответствует энергии расщепления Δ. Значение Δ обычно выражают в волновых числах ν = 1/λ см–1 *). Большинство значений Δ лежит в пределах от 10000 до 30000 см–1.


