Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Устойчивость координационных
соединений в растворахОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Устойчивость координационных
соединений в растворах Устойчивость координационных
соединений в растворах
Химические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением определяются двумя факторами: а) способностью равновесной системы при определенных условиях к превращениям; б) скоростью, с которой могут происходить превращения, ведущие к достижению равновесного состояния системы.
Первый определяет термодинамическую, а второй – кинетическую устойчивость комплексного соединения. Кинетическая устойчивость зависит от многих факторов, поэтому обычно поддается лишь качественной оценке.
В противоположность ей термодинамическая устойчивость может быть легко охарактеризована количественно с помощью констант равновесия.
В растворе ион металла M и монодентатный лиганд L взаимодействуют ступенчато с образованием комплексного иона [MLn] по схеме:
| |
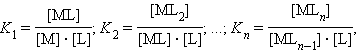 |
где Ki – ступенчатые константы образования (устойчивости) отдельных комплексов [MLi].
Поскольку в этой системе существует лишь n независимых равновесий, полная константа процесса M + nL = MLn – общая константа образования: ![]()
![]()
Чем больше константа устойчивости, тем более прочным является данный комплекс, поскольку ΔG° = –RT lnβ.
Образование прочных комплексных ионов может быть использовано для растворения труднорастворимых электролитов. Концентрация ионов в растворе определяется величиной произведения растворимости такого электролита. Добавляя в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случаях достичь растворения осадка за счет комплексообразования. Добиться этого тем легче, чем больше величина произведения растворимости и чем больше константа устойчивости комплексного иона. Например, хлорид серебра AgCl растворяется в избытке аммиака, образуя [Ag(NH3)2]Cl. Менее растворимый AgI в аммиаке практически не растворим, но растворяется в тиосульфате натрия Na2S2O3 по реакции
| |
поскольку β[Ag(S2O3)2]3– на несколько порядков больше β[Ag(NH3)2]+.
Комплексные ионы участвуют в реакциях обмена с образованием более прочного или менее растворимого соединения:
|
Здесь M = Ni2+, Cu2+, Fe2+.
Смотрите также
Заключение
29Cu – Медь
[Ar]3d104s1
Древние цивилизации оставили нам множество
изделий из бронзы.
Атомная
масса: 63,54
Электроотрицательность:
1,9
Тпл:
10 ...
Химические преобразователи солнечной энергии
Современная энергетика
опирается главным образом на такие источники, в которых запасена солнечная
энергия (СЭ). Прежде всего это ископаемые виды топлива, для образования которых
требуются ...


