Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Изомерия координационных соединенийОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Изомерия координационных соединений Изомерия координационных соединений
Многообразие координационных соединений обусловлено образованием изомеров – соединений одинаковых по составу, но отличающихся расположением лигандов вокруг центрального атома.
Гидратная (сольватная) изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней и внешней сферами. Например, CrCl3∙6H2O существует по крайней мере в трех изомерных формах:[Cr(H2O)6]Cl3 – трихлорид гексааквахрома (III+) – фиолетового цвета,[CrCl(H2O)5]Cl2∙H2O – моногидрат дихлорид пентааквахлорохрома (III+) – сине-зеленого цвета,[CrCl2(H2O)4]Cl∙2H2O – дигидрат хлорид тетрааквадихлорохрома (III+) – зеленого цвета.
Эти изомеры по-разному реагируют с раствором AgNO3. При действии AgNO3 фиолетовое соединение выделяет в осадок весь хлор, сине-зеленое – 2/3, а зеленое – только 1/3 хлора, имеющегося в соединении.
Ионизационная изомерия характеризуется различным распределением ионов между внешними и внутренними сферами комплексных соединений и, как следствие этого, различным характером диссоциации на ионы. Например, для соединения CoBrSO4∙5NH3 известны два изомера: [CoBr(NH3)5]SO4 – красно-фиолетового цвета и [CoSO4(NH3)5]Br – красного цвета.
Координационная изомерия заключается в различном распределении лигандов во внутренних координационных сферах. По-разному взаимодействуют с AgNO3 два изомера – [Co(NH3)6]∙[Cr(CN)6] и [Cr(NH3)6]∙[Co(CN)6]. Первое соединение дает осадок Ag3[Cr(CN)6], а второе – осадок Ag3[Co(CN)6].
 |
|
Рисунок 9.1 |
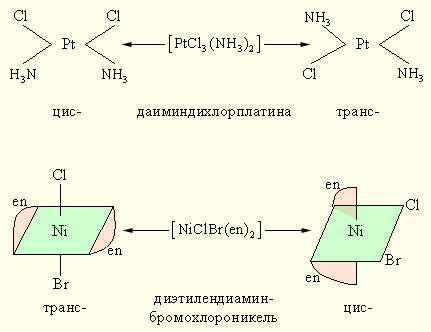
Геометрическая изомерия (цис-транс изомерия) состоит в различном пространственном расположениии лигандов вокруг центрального атома. Так, [PtCl2(NH3)2] существует в виде двух изомерных форм, отличающихся друг от друга рядом свойств.
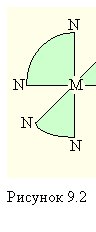
Оптическая изомерия. Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от друга направлением вращения плоскости поляризации: один называют правым, другой – левым изомером. Правые и левые изомеры оказываются зеркальными изображениями друг друга и не могут быть совмещены в пространстве (рис. 9.2).
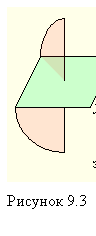
Из двух геометрических изомеров диэтилендиаминбромохлороникеля (II) только цис-изомер может существовать в виде двух оптических модификаций. Изомеры такого рода называются энантиомерами (рис. 9.3).
 |  |
Основным признаком оптически активных соединений является отсутствие плоскостей симметрии, кроме зеркальной. При смешении оптических изомеров в растворе происходит их рацемизация, приводящая к потере способности такой эквимолярной смеси вращать плоскость поляризации света из-за образования эквимолекулярной смеси лево- (l) и правовращающих (d) изомеров.
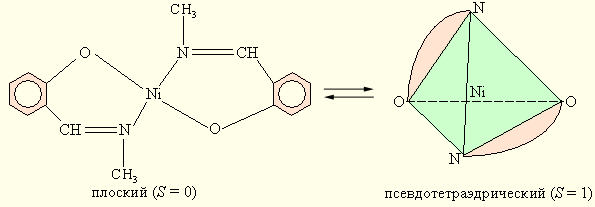
Структурная изомерия. Структурными называют такие координационные изомеры, в которых происходит изменение симметрии (стереохимии) координационной сферы. Так, у бис (N-метилсалицилиденамината) никеля (II) наблюдается равновесие между плоским и псевдотетраэдрическим строением.
 |
|
Рисунок 9.4 |
Частным случаем структурной изомерии, связанной с изменением спинового состояния центрального атома, является так называемая спиновая изомерия, при которой под воздействием внешних факторов (температуры, давления) происходит смена спинового состояния, приводящая к уменьшению межатомного расстояния центральный ион – донорный атом при переходе из высокоспинового в низкоспиновое состояние.
Смотрите также
Свойства вулканизаторов
Механические свойства
резин из фторкаучуков существенно зависят от состава смеси и метода
вулканизации. Например резины полученные радиационной вулканизацией,
превосходят перекисные по теплостойкос ...
Классы неорганических веществ. Растворы электролитов. Размеры атомов и водородная связь
...
Дисахариды и полисахариды
В
живой природе широко распространены вещества, многим из которых соответствует
формула Сх(Н2О)у. Они представляют собой,
таким образом, как бы гидраты углерода, что и обусловило их названи ...


