Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ГалогеныСтатьи и работы по химии / Статьи и работы по химии / Галогены Галогены
Галогены (от греч. halos – соль и genes – рождающий, рождённый) находятся в главной подгруппе VII группы периодической системы химических элементов.
К галогенам относят фтор, хлор, бром, иод и астат.
|
Хим. знак |
Распределение электронов |
||
|
|
по энергетическим уровням |
по энергетическим уровням и подуровням |
по орбиталям |
|
F |
+9F 2ē, 7ē |
+9F 1s22s22p5 |
1s2 2s2 2p5 +9F |
|
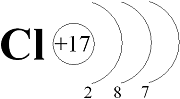
Cl |
+17Cl 2ē, 8ē, 7ē |
+17Cl 1s22s22p63s23p53d0 |
3s2 3p5 3d0 +17Cl … |
|
Br |
+35Br 2ē, 8ē, 18ē, 7ē |
+35Br …3d0 ׀ 4s24p54d0 |
4s2 4p5 4d0 +35Br … |
|
I |
+53I 2ē, 8ē, 18ē, 18ē, 7ē |
+53I …4d0 ׀ 5s25p55d0 |
5s2 5p5 5d0 +53I … |
На наружном энергетическом уровне атомов галогенов находятся семь электронов:
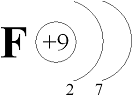
До восьми электронов (октета) на наружном энергетическом уровне, т.е. до устойчивого состояния атомов, характерного для благородных газов, атомам галогенов недостаёт по одному электрону. К тому же атомы галогенов по сравнению с атомами металлов того же периода обладают бόльшим зарядом ядра, меньшим атомным радиусом и имеют по одному неспаренному электрону. Поэтому атомы всех галогенов энергично присоединяют недостающий электрон. Например,
Cl0 + ē → Cl–.
Галогены являются сильными окислителями. Их молекулы состоят из двух атомов:
|
Химическая формула |
Структурная формула |
Электронная формула |
Образование химической связи при перекрывании электронных облаков валентных электронов |
|
F2 |
F—F |
|
|
|
Cl2 |
Cl—Cl |
|
|
Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления –1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
Смотрите также
Классификация химических элементов по Гольдшмидту. Геохимические барьеры
...
Синтез винилацетата
Среди кислородосодержащих соединений,
получаемых в промышленности основного органического и нефтехимического синтеза,
сложные виниловые эфиры, наиболее важным из которых является винилацетат ...
Молибден
...




