Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ЛантаноидыОткрытая химия / Химические свойства элементов / Открытая химия / Химические свойства элементов / Лантаноиды ЛантаноидыСтраница 2
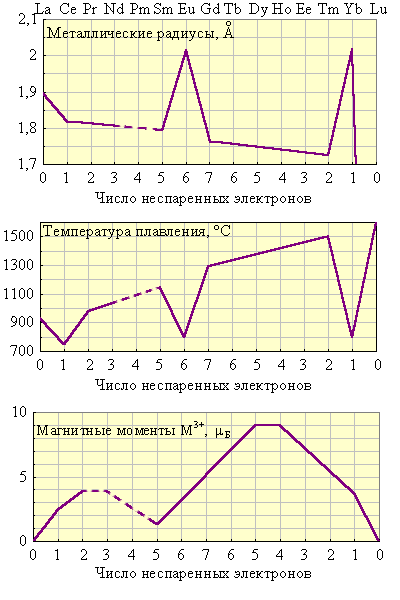
Ограниченная возможность возбуждения 4f-электронов определяет сходство химических свойств лантаноидов в одинаковых степенях окисления. Основные изменения в свойствах лантаноидов являются следствием f-сжатия, то есть уменьшения эффективных радиусов атомов и ионов с увеличением порядкового номера.
В свободном состоянии лантаноиды – весьма активные металлы. В ряду напряжений они находятся значительно левее водорода (электродные потенциалы лантаноидов составляют около –2,4 В). Поэтому все лантаноиды взаимодействуют с водой с выделением водорода:
|
Соединения лантаноидов со степенью окисления IV проявляют окислительные свойства (Ce, Tb):
| |
а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой:
| |
 |
|
Рисунок 8.15 Вторичная периодичность металлических радиусов, температур плавления, степеней окисления, магнитных моментов и окраски лантаноидов |
Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200–400 °С с образованием Э2O3, а в атмосфере азота при 750–1000 °С образуют нитриды. Церий в порошкообразном состоянии легко воспламеняется на воздухе, поэтому его используют при изготовлении кремней для зажигалок. Лантаноиды взаимодействуют с галогенами, серой, углеродом, кремнием и фосфором. Химическая активность элементов в ряду Ce–Lu несколько уменьшается из-за уменьшения их радиусов. С водородом лантаноиды образуют солеобразные гидриды ЭH2 и ЭH3, которые по свойствам более близки к гидридам щелочно-земельных металлов, чем к гидридам d-элементов. С кислородом все лантаноиды образуют оксиды типа Э2O3, являющиеся химически и термически устойчивыми; так, La2O3 плавится при температуре 2000 °С, а CeO2 – около 2500 °С. Самарий, европий и иттербий, кроме оксидов Э2O3, образуют также монооксиды EuO, SmO, YbO. Церий легко образует оксид CeO2. Оксиды лантаноидов в воде нерастворимы, но энергично ее присоединяют с образованием гидроксидов:
|
Гидроксиды лантаноидов по силе уступают лишь гидроксидам щелочно-земельных металлов. Лантаноидное сжатие приводит к уменьшению ионности связи Э–ОН и уменьшению основности в ряду Ce(OH)3 – Lu(OH)3.
Лантаноиды используют в металлургии для легирования сталей, что повышает прочность, жаростойкость и коррозийную устойчивость последних. Такие стали применяют для изготовления деталей сверхзвуковых самолетов и оболочек искусственных спутников Земли.
Добавление оксида лантана в стекла повышает их показатель преломления (так называемая лантаноидная оптика). Радиационно-оптическую устойчивость стекол повышает CeO2. Стекла с неодимом используются в оптических квантовых генераторах. Оксиды гадолиния, самария и европия входят в состав защитных керамических покрытий от тепловых нейтронов в ядерных реакторах. Соединения лантаноидов используются в качестве катализаторов. Способность их соединяться с атмосферными газами используется для создания высокого вакуума.
Смотрите также
Гомогенное химическое равновесие
1. Рассчитайте
сродство (-ΔrGt) железа к
кислороду воздуха, Po2=2,0266*104Па при 1000К, если
константа равновесия реакции 2Fe+ O2 2FeO при
этой температуре равна 2,450*1020 Па-1 ...
Использование озона
Озон -
высокоэффективное и универсальное окисляющее вещество, которое используется в
обработке воды в целях дезинфекции, удаления марганца и железа, улучшения
вкуса, устранения цвета и запа ...
Йод
ИОД (лат. Iodium), I - химический элемент VII
группы периодической
системы Менделеева, относится к галогенам (в литературе
встречается также символ J); атомный номер 53, атомная масса 126, ...


