Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Введение
Органические карбоновые кислоты характеризуются наличием карбоксильной группы -COOH или -СO2H. Все производные карбоновых кислот содержат ацильную группу R-CO-. По этой причине их часто называют также ацильными соединениями.
К основным производным карбоновых кислот (ацильным соединениям) относятся:
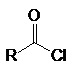
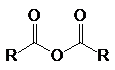
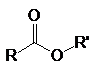
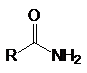
![]()
хлорангидриды кислот ангидриды сложные эфиры амиды нитрилы
Карбоксильная группа формально состоит из карбонильной и гидроксильной групп, однако, взаимодействие между ними до такой степени изменяет поведение каждой из них, что в единстве они уже представляют собой новую функциональную группу, обладающую своими собственными свойствами.
По числу карбоксильных групп различают одно-, двух-, трех- и вообще многоосновные кислоты. Карбоновые кислоты могут быть предельными (насыщенными) - карбоксил связан с алкилом, - непредельными (ненасыщенными) - карбоксил связан с непредельным радикалом и ароматическими - карбоксил связан с ароматическим радикалом.
Для карбоновых кислот чаще всего используются традиционные названия. По систематической номенклатуре кислоты называют по соответствующим углеводородам с добавлением окончания -овая и слова кислота, причем счет атомов цепи начинается от карбоксильной группы.
Упр.1.
Напишите формулы кислот: (а) пропионовой, (б) масляной, (в) изомас-ляной, (г) триметилуксусной, (д) валериановой, (е) пальмитиновой, (ж) стеариновой. Назовите их по номенклатуре IUPAC.
Упр.2.
Напишите формулы следующих кислот: (а) бензойной, (б) метилбензой-ных (толуиловых), (в) фталевых, (г) фенилуксусной, (д) коричной.
Гидроксильная группа в карбоновых кислотах образует водородные связи, причем более прочные, чем в спиртах. Кроме того, в карбоновых кислотах в образовании водородной связи может участвовать карбонильная группа. В твердом и жидком состоянии кислоты существуют в основном в виде димеров:
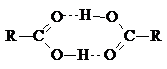
Такие димерные структуры сохраняются даже в газообразном состоянии и в растворах в воде. Способность карбоновых кислот образовывать водородные связи с водой обусловливает растворимость низжих кислот в воде. По мере увеличения длины углеродной цепи растворимость кислот в воде быстро уменьшается.
Номенклатура хлорангидридов карбоновых кислот понятна из приводимых названий хлорангидридов уксусной, пропионовой и бензойной кислот.
![]()
![]()
![]()
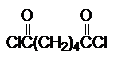
этаноилхлорид пропаноилхлорид бензоилхлорид гександиоилхлорид
(ацетилхлорид) (пропионилхлорид) (адипоилхлорид)
В водных растворах карбоновые кислоты существуют в равновесии с карбоксильным ионом:
![]() (7)
(7)
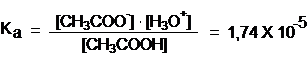
![]()
![]()
![]()
![]()
![]()
pKa 4,76 2,86 1,48 0,7 4,19
Степень диссоциации карбоновых кислот в воде относительно не велика. Тем не менее карбоновые кислоты на много порядков сильнее, чем спирты.
Смотрите также
Влияние добавок на устойчивость пероксида водорода в водных растворах
В настоящее время
пероксид водорода H2O2 находит широкое применение,
особенно в медицине, где его используют в качестве:
- антисептика в
концентрации 3%;
- стерилизующего
агента в ко ...
Концентрация растворов.
Цель работы - приобретение
навыков приготовления растворов различной концентрации из сухой соли или более
концентрированного раствора.
Приведем
несколько примеров расчета по теме "Концент ...


