Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ковалентная связь.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Ковалентная связь. Ковалентная связь.
В основе теории ковалентной связи, как и теории ионной связи, лежит представление об особой устойчивости атома, имеющего на внешнем электронном слое оболочку из восьми электронов. Отличие ковалентной связи от ионной состоит в том, что при её возникновении атомы приобретают устойчивую конфигурацию не путем отдачи или присоединения электронов, а посредством образования одной или нескольких общих электронных пар. В создании электронной пары принимают участие оба атома, отдавая на её образование по одному электрону. Эти электроны принадлежат наружным электронным слоям обоих атомов, дополняя число их электронов до восьми.
Если электроны в наружном электронном слое атома обозначить точками вокруг символа элемента, то образование ковалентной связи в молекулах фтора и азота можно представить следующей схемой:
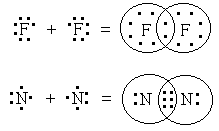
У атома фтора на внешнем слое находится семь электронов. Каждый из атомов фтора отдает по одному электрону на образование общей электронной пары, вследствие чего оба атома в молекуле фтора приобретают электронную конфигурацию ближайшего благородного газа — неона. Атомы азота, имеющие на внешнем слое по пять электронов, образуют три общие электронные пары. И в этом случае атомы в молекуле N2 приобретают устойчивую восьмиэлектронную оболочку.
Примерами более сложных соединений с ковалентной связью между атомами могут служить вода и аммиак:
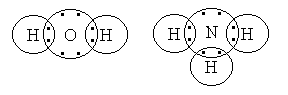
В молекуле воды каждый из атомов водорода связан с атомом кислорода парой общих электронов. При этом у кислорода возникает во внешнем слое восьмиэлектронная конфигурация, а у обоих атомов водорода появляется устойчивый двухэлектронный слой. Подобное электронное строение имеют атомы водорода в аммиаке, а связанный с ними атом азота содержит во внешнем слое восемь электронов. В молекулах фтора, азота и некоторых других молекулах, образованных одноименными или близкими по химическим свойствам атомами, возникает неполярная ковалентная связь, так как общая электронная пара расположена симметрично по отношению к ядрам обоих атомов и притягивается к ним с одинаковой силой.
В молекулах более сложных соединений, образованных элементами с различными химическими свойствами (NH3, H2S, H2O, HCl, HBr и др.), общая электронная пара смещена в большей или меньшей мере к одному из атомов.
Смотрите также
Изучение кето-енольной таутомерии на примере АУЭ
Цели работы
определены следующим образом:
1.
Изучить строение и свойства, а так
же особенности с ...
Индол. Порфин. Тетраазапорфин. Фталоцианины
Введение
Гетероциклическими
называют соединения, содержащие циклы, включающие один или несколько
гетероатомов. Наиболее устойчивыми являются пяти- и шестичленные циклы.
Гетероцикли ...


