Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
d-ЭлементыОткрытая химия / Химические свойства элементов / Открытая химия / Химические свойства элементов / d-Элементы d-ЭлементыСтраница 2
По мере увеличения числа d-электронов в периоде они могут переходить с одного уровня на другой для достижения требуемой правилами Гунда одной из наиболее устойчивых конфигураций (d5, d10). Такие переходы реализуются, например, в случае Cr(3d54s1), Cu(3d104s1), Mo(4d55s1), Ag(4d105s1). Обращает на себя внимание тот факт, что в одной подгруппе существуют элементы с разными электронными конфигурациями, например: V(3d34s2), Nb(4d45s1) и Ta(5d36s2); Ni(3d84s2), Pd(4d105s0) и Pt(5d96s1). Палладий является единственным d-элементом с незаполненным s-уровнем.
d-Элементы обладают некоторыми особенностями по сравнению с элементами главных подгрупп.
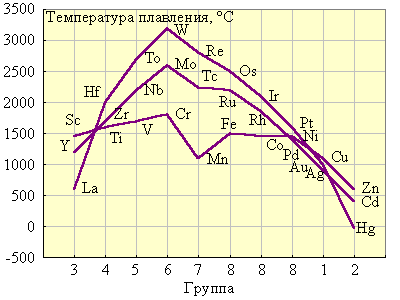
1. У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу (тогда как у щелочных и щелочноземельных металлов валентные электроны полностью отданы в коллективное пользование). Остальные d-электроны участвуют в образовании направленных ковалентных связей между соседними атомами. Таким образом, эти элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы (рис. 8.11).
 |
|
Рисунок 8.11 Температура плавления d-элементов |
Из рис. 8.11. видно, что наиболее тугоплавки металлы VВ и VIВ подгрупп. У них заполняется электронами половина d-подуровня и реализуется максимально возможное число неспаренных электронов, а следовательно, наибольшее число ковалентных связей. Дальнейшее заполнение приводит к уменьшению числа ковалентных связей и падению температур плавления.
2. Вследствие незаполненности d-оболочек и наличия близких по энергии незаполненных ns- и np-уровней, d-элементы склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны.
3. d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
4. Для d-элементов характерен большой набор валентных состояний (табл. 8.10) и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах.
Поскольку часть валентных электронов находится на s-орбиталях, то проявляемые ими низшие степени окисления как правило равны двум. Исключение составляют элементы, ионы которых Э+3 и Э+ имеют устойчивые конфигурации d0, d5 и d10: Sc3+, Fe3+, Cr+, Cu+, Ag+, Au+.
Соединения, в которых d-элементы находятся в низшей степени окисления, образуют кристаллы ионного типа, в химических реакциях проявляют основные свойства и являются, как правило, восстановителями.
Устойчивость соединений, в которых d-элементы находятся в высшей степени окисления (равной номеру группы),увеличивается в пределах каждого переходного ряда слева направо, достигая максимума для 3d-элементов у Mn, а во втором и третьем переходных рядах – у Ru и Os соответственно. В пределах одной подгруппы стабильность соединений высшей степени окисления уменьшается в ряду 5d > 4d > 3d, о чем свидетельствует характер изменения энергии Гиббса (изобарно-изотермического потенциала) однотипных соединений, например:
| |||||||||||||
|
Таблица 8.11 Энтальпии образования высших оксидов VIB и VIIB подгрупп |
Смотрите также
Амины жирного ряда (алифатические амины)
Изомерия в ряду алифатических аминов связана с изомерией
углеводородного радикала и количеством заместителей у атома азота.
Многие амины имеют тривиальные названия. По рациональной
номенклатуре н ...
Растворы и растворители
Растворы
и растворители. Участие растворителей в кислотно-основном взаимодействии. Протеолитическая
теория кислот и оснований. Способы выражения концентрации растворов. Буферные
растворы и ...


