Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ионная связь.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Ионная связь. Ионная связь.Страница 1
Для объяснения химической связи между атомами в молекулах солей, оксидов и щелочей наиболее пригодна теория, в основу которой положено представление об ионной связи.
Согласно теории ионной связи, самой устойчивой электронной конфигурацией атома является такая, при которой во внешнем электронном слое находится восемь или два электрона (подобно благородным газам). Довольно устойчивы также атомы, внешнего слой который содержит 18 электронов.
Во время химических реакций атомы стремятся приобрести наиболее устойчивую электронную конфигурацию. Это достигается в результате присоединения электронов атомов других элементов или отдачи электронов из внешнего слоя другим атомам. Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно заряженными ионами. Атомы, присоединившие электроны, превращаются в отрицательно заряженные ионы. Разноимённо заряженные ионы удерживаются друг около друга силами электростатического притяжения.
В качестве примера соединения с ионной связью рассмотрим хлорид натрия. Образование этого соединения схематически можно представить следующим образом. Атом натрия, имея электронную конфигурацию 1s22s22р6Зs1, легко отдает 3s-электрон, так как имеет низкую (493 кДж/моль) энергию ионизации. При этом атом натрия приобретает устойчивую электронную конфигурацию из восьми электронов 2s22р6, характерную для благородных газов:
Nа = Nа+ + е-.
Электронной конфигурации атома хлора 1s22s22р6Зs2Зр5 до устойчивого состояния не хватает одного электрона. Вследствие большого сродства к электрону (365 кДж/моль) атом хлора легко присоединяет один электрон. Во внешнем слое при этом возникает устойчивая электронная конфигурация Зs2Зр6:
Сl +е- = Сl-.
Разноимённо заряженные ионы натрия и хлора, возникающие в результате перехода электрона от атома натрия к атому хлора, взаимно притягиваются и образуют хлорид натрия — соединение ионного типа:
Nа+ + С1- = Nа+Cl-.
Молекулы, образованные из противоположно заряженных ионов называют ионными молекулами, а химическую связь в таких молекулах — ионной связью.
|
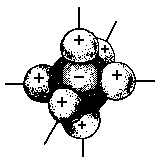
Рис. 1. Координация ионов в кристалле хлорида натрия. |
Ионная связь не имеет определенной пространственной направленности, так как электрическое поле иона обладает сферической симметрией и одинаково убывает с расстоянием в любом направлении. Поэтому взаимодействие ионов не зависит от направления. Создаваемое ионами в окружающем пространстве электрическое поле тем сильнее, чем выше заряд иона и меньше его радиус.
Вследствие сферической симметрии электрического поля иона два разноименных иона, притянувшись друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. Именно поэтому данный ион может координировать вокруг себя еще некоторое число ионов противоположного знака. Указанные свойства ионной связи обусловливают способность ионных молекул соединяться друг с другом. В газообразном состоянии ионные соединения находятся в виде отдельных неассоциированных молекул, так как при высоких температурах кинетическая энергия молекул превышает энергию их взаимного притяжения. Ионные молекулы существуют в тех находящихся в газообразном состоянии веществах, которые при охлаждении образуют геометрически правильные структуры, составляющие основу кристалла. Так, кристалл хлорида натрия представляет собой сочетание огромного множества ионов Nа+ и С1-, определенным образом ориентированных друг относительно друга.
Смотрите также
Атомно-молекулярное учение и его законы
Химия - наука о веществах, изучающая их состав, строение,
свойства, а также превращения веществ, на сопровождающиеся изменением состава
атомных ядер.
Использование для нужд человека природных рес ...
Характеристика химического элемента №16 (Сера)
...
Проблемы и решения на уровне структурной химии
В данном разделе
речь идет об особом уровне развития химических знаний, на котором
главенствующую роль играет структура молекулы реагента.
Свойства веществ,
и их качественное разнообразие, обусл ...