Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Идентификация кинетических параметров процессов растворенияДипломы, курсовые и прочее / Растворение твердых веществ / Дипломы, курсовые и прочее / Растворение твердых веществ / Идентификация кинетических параметров процессов растворения Идентификация кинетических параметров процессов растворения
Если бы найденные нами из экспериментальных исследований константы (константы скорости, порядки реакций и т.д.) использовались для расчета реакторов того же масштаба, что и экспериментальный, то задачу по определению констант можно было бы считать выполненой. Но масштабы промышленных и лабораторных реакторов-растворителей различаються на несколько порядков. Поэтому из экспериментально определенных кажущихся констант и порядков необходимо извлечь то, что характеризует саму химическую реакцию и не зависит от размеров реактора и его элементов. Такое экспериментально-теоретическое исследование называют идентификацией – опознаваемым параметров уравнения кинетики. При идентификации параметров уравнения кинетики гетерогенного процесса необходимо исходить из представлений о лимитирующей стадии процесса.
Признаки, по которым различают в какой области кинетики лежит процесс растворения, представлены в таблице 1.
Таблица 1
Основные признаки различных областей кинетики растворения
|
Факторы, характеризующие растворение |
Область кинетики | |
|
диффузионная область |
собственно кинетическая | |
|
1.Величина коэффициента скорости растворения k (см/сек) при 250С |
10-2÷10-3 |
10-6÷10-7 |
|
2.Температурный коэффициент скорости растворения, kt+10/kt |
≤ 1,5 |
≥ 2 |
|
3.Величина энергии активации растворения Е[кДж/моль] |
≤ 20 |
≥ 40 |
|
4.Зависимость скорости процесса от интенсивности перемешивания раствора |
зависит |
зависит |
|
5.Влияние вязкости раствора на скорость растворения |
влияет |
не влияет |
Ответ о типе кинетики растворения взвешенных кристаллов солей дает уравнение А.Б. Здановского, выведенное из теории подобия и аналитическим путем:
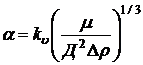 ,
,
где kυ – коэффициент скорости растворения при объемном выражении концентраций (см/сек);
μ – динамическая вязкость пограничного раствора, (г/см·сек);
Д – коэффициент диффузии, (см2/сек);
Δr – разность плотностей кристалла и растворителя (г/см3).
Если α = 15±2, то имеет место диффузионная кинетика растворения.
Если α < 1, то мы имеем дело с кинетической областью.
Если a = 13 ¸ 1, то растворение протекает в переходной области.
Следует также помнить, что подавляющее процессов химического растворения веществ описываются уравнением реакции первого порядка.
Смотрите также
Губчатые изделия
Тема данной курсовой работы «Губчатые изделия», эта тема довольно
актуальна, так как производство губчатых изделий занимает не маловажное место в
промышленности. Потому что эти изделия имеют ...
Определение уроновых кислот и полиуронидов
В состав кислых полисахаридов и полиуронидов древесины
входят звенья двух гексуроновых кислот — D-глюкуроновой
и D-галактуроновой. Звенья D-глюкуроновой
кислоты преимущественно содержатся в ...


