Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ГексафенилэтанСтатьи и работы по химии / Ароматические соединения с конденсированными ядрами / Статьи и работы по химии / Ароматические соединения с конденсированными ядрами / Гексафенилэтан Гексафенилэтан
В 1900 г. Гомберг действием металлами (Zn, Cu, Hg, Ag) на трифенилхлорметан считал, что получил ГФЭ.
![]()
Однако в настоящее время установлено, что полученный углеводород имеет структуру 1-(дифенилметилен)-4-трифенил-2,5-циклогексадиена
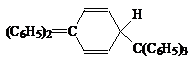
бесцветное кристаллическое вещество с т. пл. 2310С, легко вступает в реакции Na, I2, O2.
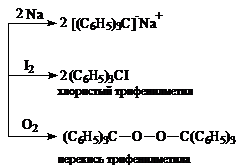
В растворах это соединение частично диссоциирует на свободные радикалы, что приводит к изменению бесцветной окраски на желтую.
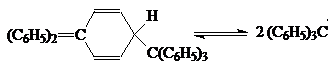
Впервые существование устойчивого трифенилметильного радикала было обнаружено Гомбергом при решении задачи синтеза ГФЭ по реакции Вюрца. Наличие свободных радикалов в растворе установлено по парамагнитным свойствам этих частиц, где не скомпенсированный спин электрона создает магнитное поле вокруг свободного радикала.
Фактически с O2, I2 и Na взаимодействуют не ГФЭ, а именно радикал трифенилметил. Для диссоциации СН3-СН3 требуется 85 ккал/моль, а для (С6Н5)3С-С(С6Н5)3 необходимо всего 12 ккал/моль. Причина понижения энергетического уровня связаны с высокой устойчивостью (С6Н5)3С, которая вызвана тем, что неспаренный электрон не концентрируется на атоме углерода, а рассредоточен по всем бензольным ядрам благодаря сопряжению. Эта причина устойчивости радикала - главная. Однако есть и вторая - рекомбинация радикалов препятствуют пространственные затруднения.
Смотрите также
Амины
По
систематической номенклатуре амины называют путем добавления приставки амин к
названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил
или ариламины.
Гетероциклич ...
Нитрование n-нитроацетанилид
Нитрования – один
из важнейших процессов в химической промышленности. Продукты, получаемые за
счёт нитрования, являются полуфабрикатами для производства многих товаров
различных назначений ...
Применение каучуков
Фторкаучуки – каучуки
специального назначения, применяемые в производстве изделий и деталей, в
которых должны сочетаться высокая стойкость к действию агрессивных сред и
теплостойкость. Фторкаучуки ...


