Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Классификация электродовДипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Дипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Классификация электродов Классификация электродовСтраница 1
Классификация электродов проводится по химической природе веществ Ox и Red, участвующих в электродном процессе.
Электродом 1-ого рода называют систему, в которой восстановленной формой является металл электрода, а окисленной формой – простые или комплексные ионы этого же металла.
Примером может служить система Cu2++2e-=Cu, для которой:
![]() (1.2.1)
(1.2.1)
Как правило, электроды 1-ого рода обратимы по катиону, т.е. их потенциал является функцией активности катиона. Однако, есть небольшое количество электродов 1-ого рода, обратимых по аниону, например 2Te+2e-=![]() , для которого
, для которого
![]() (1.2.2)
(1.2.2)
К электродам 1-ого рода относятся амальгамные электроды, в которых восстановленной формой служит амальгама какого-либо металла, а окисленной – ионы того же металла:
Tl++e-(Hg)=Tl(Hg)
Поскольку в таких системах может изменяться концентрация как Ox, так и Red, то
![]() (1.2.3)
(1.2.3)
Здесь ![]() - активность таллия в амальгаме.
- активность таллия в амальгаме.
Общая формула для потенциала электрода 1-ого рода имеет вид:
![]() (1.2.4)
(1.2.4)
Здесь ![]() - активность потенциалопределяющих ионов в растворе,
- активность потенциалопределяющих ионов в растворе, ![]() - зарядовое число потенциалопределяющих ионов с учетом знака;
- зарядовое число потенциалопределяющих ионов с учетом знака; ![]() - активность соответствующего металла. Для чистых металлов
- активность соответствующего металла. Для чистых металлов ![]() =const и соответствующий член
=const и соответствующий член ![]() вводится в стандартный потенциал.
вводится в стандартный потенциал.
Электродом 2-ого рода называют систему, в которой металл покрыт слоем его труднорастворимой соли (или оксида), а раствор содержит анионы этой соли (для оксида – ионы OH-):
![]()
Таким образом, окисленной формой здесь является труднорастворимая соль ![]() , а восстановленная форма представлена металлом
, а восстановленная форма представлена металлом ![]() и анионом
и анионом ![]() . Потенциал электрода 2-ого рода определяется активность ионов соответствующего металла
. Потенциал электрода 2-ого рода определяется активность ионов соответствующего металла ![]() , которую можно выразить через произведение растворимости соли Ls и активность аниона
, которую можно выразить через произведение растворимости соли Ls и активность аниона ![]() . Таким образом, уравнение Нернста для электродов 2-ого рода принимает вид:
. Таким образом, уравнение Нернста для электродов 2-ого рода принимает вид:
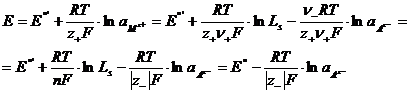 (1.2.5)
(1.2.5)
Здесь ![]() - стандартный потенциал системы Мz+/М;
- стандартный потенциал системы Мz+/М; ![]() - стандартный потенциал электрода 2-ого рода. Как следует из уравнения (1.2.5), электрод 2-ого рода является обратимым по аниону.
- стандартный потенциал электрода 2-ого рода. Как следует из уравнения (1.2.5), электрод 2-ого рода является обратимым по аниону.
Рассмотрим некоторые примеры электродов 2-ого рода.
Хлорсеребряный электрод: AgCl+e-=Ag+Cl-
![]() (1.2.6)
(1.2.6)
Каломельный электрод: Hg2Cl2+2e-=2Hg+2Cl-
![]() (1.2.7)
(1.2.7)
Смотрите также
Химический состав минеральных вод
Лечебными минеральными водами называются природные воды, которые
содержат в повышенных концентрациях те или другие минеральные (реже
органические) компоненты и газы и (или) обладают какими-н ...
Исследование распределения и накопления трихлоруксусной кислоты в модельных системах и природных водах
Экология,
загрязнение окружающей среды, экологический мониторинг, экологическая химия —
часто встречающиеся в наше время слова и сочетания, выражающие всеобщую
озабоченность состоянием прир ...
Химия в быту
В моем реферате
пойдет речь о химических веществах, применяемых в быту и облегчающих домашний
труд, ведь бытовая химия - это не только стирка, уборка, но и покраска, очистка помещений, отдел ...


