Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диаграммы электрохимического равновесия системДипломы, курсовые и прочее / Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si / Дипломы, курсовые и прочее / Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si / Диаграммы электрохимического равновесия систем Диаграммы электрохимического равновесия системСтраница 2
Наклонные линии (![]() и
и ![]() ) отображают равновесия, в которых участвуют ионы Н+ и ОН - совместно с электронами; горизонтальные линии (m=0) - равновесия, в которых участвуют электроны, но не принимают участия ионы Н+ и ОН-; вертикальные линии (n=0) - равновесия, в которых принимают участие ионы Н+ и ОН-, но не учавствуют электроны. Последнее равновесие является химическим, поэтому не может быть рассчитано по формуле (1.28).
) отображают равновесия, в которых участвуют ионы Н+ и ОН - совместно с электронами; горизонтальные линии (m=0) - равновесия, в которых участвуют электроны, но не принимают участия ионы Н+ и ОН-; вертикальные линии (n=0) - равновесия, в которых принимают участие ионы Н+ и ОН-, но не учавствуют электроны. Последнее равновесие является химическим, поэтому не может быть рассчитано по формуле (1.28).
Вместо него применяют уравнение:
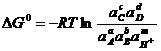 ; (1.29)
; (1.29)
![]() ; (1.30)
; (1.30)
Затем определяют значение рН для вертикальной линии по уравнению:
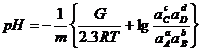 ; (1.31)
; (1.31)
Как ранее упоминалось, на полные диаграммы рН-потенциал наносят семейства линий при активностях ионов в растворе равных 100, 10-2, 10-4, 10-6 моль, соответственно обозначаемые 0, - 2, - 4, - 6.
Для характеристики коррозионных процессов можно использовать упрощенные диаграммы рН-потенциал. Для этого или объединяют отдельные кривые, соответствующие различным активностям (проводят усредненную кривую), в одну, либо строят диаграмму только для одной из активностей ионов в растворе.
Диаграмма рН-потенциал системы Si-H2O и Ni-O
Диаграмма электрохимического равновесия системы Si-H2O представлена на рис.1.5 [7].
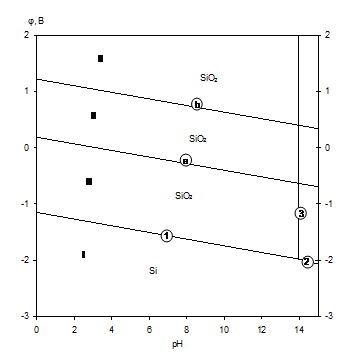
Рис.1.5 Диаграмма рН-потенциал для системы Si-H2O при 25 0С,
1 атм. (воздух) и ![]() =1.
=1.
Линии "а" и "b" на диаграмме ограничивают область термодинамической устойчивости воды. В области 1 кремний находится в виде оксида кремния SiO2.
Основные химические и электрохимические равновесия приведены в таблице 1.6.
Таблица 1.6.
Основные химические и электрохимические равновесия в системе Si-H2O при 25 0С, 1 атм. (воздух) и ai=1
|
№ на рис. |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
a |
(0,01 об. % возд.) |
0,186-0,0591рН |
|
b |
|
1,219-0,0591рН |
|
1 |
|
-1,151-0,0591рН |
|
2 |
|
-0,739-0,0887рН |
|
3 |
|
рН 13,94 |
Линии "а" и "b" на диаграмме ограничивают область термодинамической устойчивости воды. В области 1 кремний находится в виде оксида кремния SiO2.
Диаграмма рН-потенциал системы Ni-H2O приведена на рис.1.6 [10].
На диаграмме можно выделить 4 области преобладания различных фаз:
I - Ni - область иммунности
II - Ni2+ - область активной коррозии
III - NiOx - область пассивности
IV - ![]() - область транспассивности.
- область транспассивности.
Смотрите также
Применение каучуков
Фторкаучуки – каучуки
специального назначения, применяемые в производстве изделий и деталей, в
которых должны сочетаться высокая стойкость к действию агрессивных сред и
теплостойкость. Фторкаучуки ...
Алифатические амины. Ароматические амины
Химические свойства аминов ...


