Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Общая характеристика и номенклатура
свободных радикалов. Что такое
свободные радикалыДипломы, курсовые и прочее / Роль свободных радикалов в природной среде / Дипломы, курсовые и прочее / Роль свободных радикалов в природной среде / Общая характеристика и номенклатура
свободных радикалов. Что такое
свободные радикалы Общая характеристика и номенклатура
свободных радикалов. Что такое
свободные радикалы
Хорошо известно, что в органических молекулах (включая те, из которых состоит наш организм) электроны на внешней электронной оболочке располагаются парами: одна пара на каждой орбитали (рис. 1)
Свободные радикалы отличаются от обычных молекул тем, что у них на внешней электронной оболочке имеется неспаренный (одиночный) электрон (рис. 2 и 3).
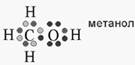
Рисунок 1.1. Электронная структура молекулы метанол
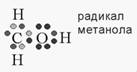
Рисунок 1.2. Электронная структура радикала метанола
Неспаренный электрон в радикалах принято обозначать точкой. Например, радикал гидроксила обозначают как HO·, радикал перекиси водорода как HOO·, радикал супероксида как ·OO- или O2·-. Ниже даны формулы трех радикалов этилового спирта: CH3CH2O·; CH3·CHOH; CH3CH2O·
Итак:
· Свободным радикалом называется частица - атом или молекула, имеющая на внешней оболочке один или несколько неспаренных электронов.
· Это делает радикалы химически активными, поскольку радикал стремится либо вернуть себе недостающий электрон, отняв его от окружающих молекул, либо избавиться от "лишнего" электрона, отдавая его другим молекулам.
· В особом положении оказалась молекула кислорода (диоксигена), которая содержит на внешней оболочке целых два неспаренных электрона. Таким образом, диоксиген - это бирадикал и, подобно другим радикалам, обладает высокой реакционной способностью.

Рисунок 1.3. Электронная структура некоторых молекул и радикалов
Важно подчеркнуть, что неспаренные электроны должны находиться на внешней оболочке атома или молекулы. В понятие свободного радикала не включаются ионы металлов переменной валентности, неспаренные электроны в которых находятся на внутренних оболочках. Поскольку и радикалы и ионы таких металлов как железо, медь или марганец (так же как комплексы этих металлов) дают сигналы электронного парамагнитного резонанса (ЭПР), эти частицы в совокаупности часто называют парамагнитными центрами.
Образование радикалов из устойчивых молекул обусловлено, таким образом, появлением на свободной, валентной орбитали нового электрона или наоборот - удалением одного электрона из электронной пары. Эти процессы обычно происходят в результате реакций одноэлектронного окисления или восстановления. В таких реакциях обычно участвует, наряду с молекулой, из которой радиукал образуется, ион металла переменной валентности, который ка раз и служит донором или акцептором одного электрона (а не двух сразу, как это бывает в реакиях между двумя органическими молекулами или между органической молекулой и кислородом). Типичный пример реакции, в которой образуется радикал - это реакция Фентон: взаимодействие пероксида водорода с ионом двухвалентного железа:
Fe2+ + H2O2 => Fe3+ + OH- + ·OH (радикал гидроксила)
При высоких температурах или под действием ультрафиолетового излучения радикалы могут образовываться также в результате разрыва химической связи (гомолитическое расщепление). В обычных условиях такие реакции в нормальных живых клетках практически не имеют места.
Смотрите также
Монокристаллический кремень
Основной объем
монокристаллического кремния (80-90%) потребляемого электронной
промышленностью, выращивается по методу Чохральского.
Фактически весь кремний,
используемый для производст ...
Ионные реакции в растворах. Солевой эффект (в ТАК)
Теория
активированного комплекса позволяет элегантно объяснить специфические
особенности кинетики ионных реакций в жидкой фазе.
Теория
Активированного Комплекса – Теория Переходного Сост ...
Пептиды и первичная структура белка
Пептиды и белки
представляют собой высокомолекулярные органические соединения, построенные из
остатков α-аминокислот, соединенных между собой пептидными связями.
Ни один из
известны ...


