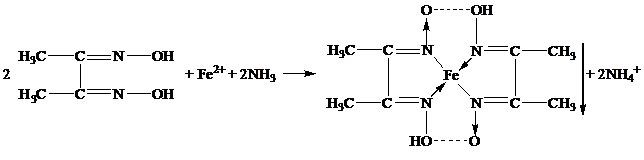Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Хелаты
Термин хелат (англ. chelate от греческого «клешня») принят для обозначения циклических структур, которые образуются в результате присоединения катиона к двум или более донорным атомам, принадлежащим одной молекуле комплексона. В соответствии с термином хелат эти соединения следует представлять в виде какого-то краба, который своими полидентатными клешнями прочно захватывает ион металла, и чем больше клешней, тем прочнее захват. Как буквальный перевод слова chelate в литературе до сравнительно недавнего времени для обозначения комплексных соединений с циклическими структурами использовался термин "клешневидные соединения" [16].
Замыкание циклов при образовании хелатных соединений является важным фактором, обусловливающим высокую устойчивость комплексонатов. Комплексные соединения, содержащие циклические группировки, отличаются более высокой прочностью, чем соединения, не содержащие циклов, а наибольшей устойчивостью обладают комплексы с пяти- и шестичленными циклами.
Хелатные комплексы наиболее характерны для комплексонов. Термин «комплексоны» предложен в 1945 году профессором Цюрихского университета Г. Шварценбахом (1904 — 1978) для органических лигандов группы полиаминополикарбоновых кислот [16].
Наиболее часто используемым комплексоном является этилендиаминтетраацетат (ЭДТА, трилон-Б).
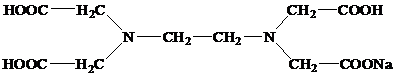
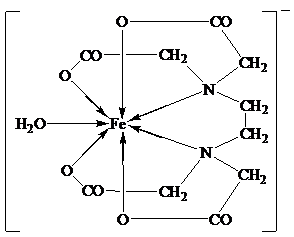
Комплекс железа с ЭДТА ([Fe(ЭДТА)(H2O)]-) относится к числу низкоспиновых[14]. В нем лиганд ЭДТА4-, как обычно, гексадентантен. Однако, КЧ иона Fe3+ равно 7, поскольку, кроме четырех атомов кислорода и двух атомов азота, ЭДТА4- во внутреннюю сферу КС входит атом кислорода внутрисферной гидратной воды:
Образование хелатных структур характерно не только для комплексонов, но для других органических соединений. Например, очень устойчивы КС железа с бета-дикетонами. Простейший из бета-дикетонов железа – трисацетилацетонат Fe(AcAc)3 [14].
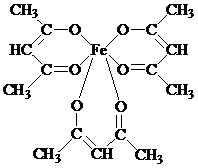
При нагревании сублимируется без разложения. В его молекуле имеются 3 шестичленных хелатных цикла. Несмотря на принадлежность к высокоспиновым соединениям, трисацетилацетонат железа (III) ведет себя как соединение с молекулярной структурой: ионная составляющая связи FeIII – лиганд экранируется углеводородными радикалами лиганда, в результате чего для соединения характерно слабое «органоподобное» межмолекулярное взаимодействие. Это объясняет его способность растворяться в малополярных растворителях и легко сублимироваться (150 0С).
В качестве неофициальных реакций наиболее чувствительным реактивом на железо (II) является спиртовой раствор диметилглиоксима, который образует с железа (II) ионом комплексное хелатное соединение красного цвета, нерастворимое в растворе аммиака [11]: