Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Слабые электролиты. Закон разбавления ОствальдаДипломы, курсовые и прочее / О растворах / Дипломы, курсовые и прочее / О растворах / Слабые электролиты. Закон разбавления Оствальда Слабые электролиты. Закон разбавления Оствальда
Диссоциация слабых растворов – обратимый процесс, к которому применим закон действия масс:
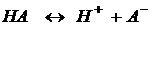
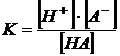
Константу равновесия процесса диссоциации называют константой диссоциации.
Если диссоциация слабого электролита протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
1-я ступень: ![]()
2-я ступень: ![]()
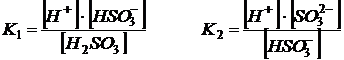
При этом K1>K2, а Kсум = K1·K2
Константа диссоциации не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Kдисс < 104.
Рассмотрим процесс диссоциации электролита НА с концентрацией с
и степенью диссоциации ![]() :
:
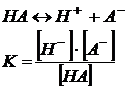
Согласно уравнению диссоциации:
![]()
Тогда
![]()
После подстановки полученных выражений в уравнение для константы диссоциации получим:
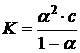
Так как ![]() <<1, то её величиной в знаменателе можно пренебречь:
<<1, то её величиной в знаменателе можно пренебречь:
![]()
или
![]()
Полученное соотношение является математическим выражением закона разбавления Оствальда: степень диссоциации электролита возрастает при разбавлении раствора.
Смотрите также
Акридон. Его получение, свойства и применение
...
Принципы определения примесей арсена в неизвестном минерале
В условиях активного загрязнения окружающей
среды и реальности экологического кризиса возрастает значение научных
исследований, направленных на изучение состояния экосистемы, и практического ...
Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева
...


