Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Окислительное хлорирование этилена.Дипломы, курсовые и прочее / Физико-химия конкретных промышленных каталитческих процессов / Дипломы, курсовые и прочее / Физико-химия конкретных промышленных каталитческих процессов / Окислительное хлорирование этилена. Окислительное хлорирование этилена.
С2H4 + 2HCl + 0,5O2 = C2H4Cl2 + H2O
2 C2H4Cl2 = C2H3Cl + HCl
С2H4 + Cl2 = C2H4Cl2
2 С2H4 + Cl2 + 0,5O2 = 2C2H3Cl + H2O
Катализатор – CuCl2/Al2O3
Температура 220-2700С.
Давление 3,5-4,5 атм.
Состав смеси на входе в реактор
HCl – 30%
С2H4- 15,5%
O2 – 11%.
Остальное – азот («воздушный» процесс) или азот + диоксид углерода («кислородный» процесс).
Преимущества (уменьшение выбросов дихлорэтана и потерь этилена) и недостатки (затраты на разделение воздуха и на циркуляцию смеси) «кислородного» процесса.
Механизм процесса по данным стационарных и нестационарных кинетических измерений.
Окисление этилена в окись этилена. Основные направления развития «кислородного» процесса. Механизм влияния соединений хлора на селективность и активность.
C2H4 + 0,5O2 = C2H4O + 27 ккал/моль
C2H4 + 3O2 = 2CO2 + 2H2O + 330 ккал/моль
Температура 220-2700С
Давление 20 и более атмосфер.
Катализатор – 11-13% Ag с добавками/Al2O3 (корунд)
Роль добавок и особенности приготовления катализаторов.
Состав смеси на входе в реактор
«воздушный» процесс
O2 – 7%
C2H4- 4% (конверсия этилена – 0,3)
CO2 – 7%
остальное – азот;
«кислородный» процесс
O2 – 7% (конверсия килорода – 0,3)
C2H4- выше 15%
CO2 – 7%
остальное – азот и (или) метан.
Влияние хлорсодержащих соединений на процесс.
Роль теплосъема, “runaway”, “decomp”.
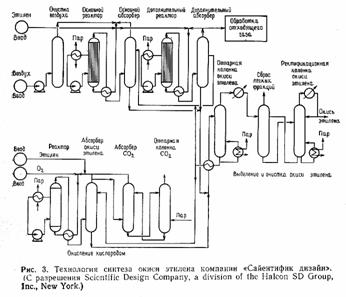 |
Окисление бутана в малеиновый ангидрид. Окисление метанола в формальдегид на серебряных катализаторах.
Особенности процессов в реакторах с восходящим потоком и в условиях, когда реакция определяется внешним тепло- и массопереносом.
Смотрите также
Определение состава стиральных порошков
Ещё лет
10-15 назад название используемых синтетических моющих средств (СМС), в особенности
стиральных порошков можно было легко перечислить: Астра, Эра, Лотос, так как их
набор не отличалс ...
Атомно-молекулярное учение и его законы
Химия - наука о веществах, изучающая их состав, строение,
свойства, а также превращения веществ, на сопровождающиеся изменением состава
атомных ядер.
Использование для нужд человека природных рес ...
Заключение
При обычном давлении существует только одна
ромбоэдрическая модификация висмута (параметры решетки с периодом а = 0,4746 нм
и углом = 57,23°). При плавлении висмут уменьшается в объёме (как лёд), то ...


