Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
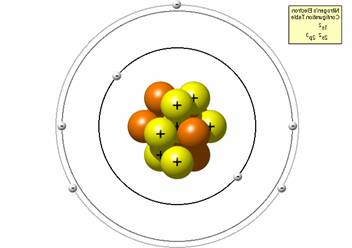
Свойства азота. Изотопы, атом, молекулаДипломы, курсовые и прочее / Свойства азота / Дипломы, курсовые и прочее / Свойства азота / Свойства азота. Изотопы, атом, молекула Свойства азота. Изотопы, атом, молекулаСтраница 2
Энергия диссоциации моля (28,016 г или 6,023·10²³ молекул) молекулярного азота на атомы (N2 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие s- и p-орбитали. Молекула азота немагнитна (диамагнитна).Молекула N2 является наиболее прочной среди гомоатомных молекул типа A2 . Энергия диссоциации N2 на два атома азота (Eд) составляет 941,6 кДж/моль. Валентная оболочка двухатомных молекул (N2 , CO, O2 , NO, F2) состоит из трех связывающих и трех разрыхляющих молекулярных орбиталей (МО). На трех связывающих МО молекулы N2 находятся шесть 2p-электронов двух атомов азота, причем 4p-электрона размещаются на двух p-орбиталях (1pu) и 2p-электрона - на верхней s-орбитали (3sg):
На этой диаграмме молекулярных орбиталей цифры обозначают номер орбитали данного типа, pu и sg - связывающие p- и s-, а и - разрыхляющие МО. Таким образом, высшая занятая МО из трех образующих тройную связь, за счет которой молекула N2 проявляет донорные свойства, является s-МО в отличие от молекулы С2Н2 , в которой высшие занятые МО - орбитали p-типа.
Энергия отрыва электрона (потенциал ионизации I ) с 3sg-орбитали N2 очень высока, близка к потенциалу ионизации инертного газа аргона и намного выше потенциала ионизации ксенона и кислорода: = 15,6 эВ, IAr = 15,76 эВ, IXe = 12,1 эВ, = 12,1 эВ. Пары 2s-электронов, которые обычно изображают в виде точек на атомах азота (:NЇN:), вообще не участвуют во взаимодействии с акцепторами электронов, так как находятся на 2sg- и -МО, лежащих существенно ниже 1pu-МО, потенциал ионизации которой 17,1 эВ. Именно из-за слабых электронодонорных свойств N2 только очень сильные акцепторы в газовой фазе (H+, BF3) взаимодействуют с этой молекулой: , F3B(N2).
Молекула азота является к тому же и плохим акцептором электронов. Сродство к электрону N2 сильно отрицательно ( эВ) и намного ниже, чем у атома K (FK = - 0,9 эВ). Поэтому только очень сильные восстановители (например, Li0) участвуют в одноэлектронном восстановлении N2 с последующим образованием нитрида:
N2+3Li=2Li3N
Низшее возбужденное состояние N2 , которое возникает при переходе электрона с 3sg-МО на 1-орбитали, очень реакционноспособно, но лежит выше основного на 606 кДж/моль и поэтому труднодостижимо. Потеря одного электрона слабо сказывается на величине Eд и лишь появление электрона на 1-орбитали приводит к снижению Eд . При этом величина Eд частицы становится близкой к Eд изоэлектронной молекулы NO, в которой пятнадцатый электрон расположен на разрыхляющей 2pp*-молекулярной орбитали (Eд(NO) = 627 кДж/моль).
Кроме отмеченных особенностей N2 имеется еще одна термодинамическая причина, определяющая инертность молекулы азота. В отличие от других молекул с тройной связью (HCЇCH, RCЇN, CЇO) разрыв первой из трех связей в N2 требует наибольших затрат энергии [16].
Смотрите также
Реакции замещения гидроксильной группы
...
Нестандартные вопросы химии и их решения
1. «Поющая
колба». Выделение энергии в ходе химических реакций происходит обычно в
виде теплоты, света или других электромагнитных излучений. Обсудите возможность
выделения энергии химическ ...
Алкалоиды
...


