Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Растворы сильных электролитовОткрытая химия / Растворы / Открытая химия / Растворы / Растворы сильных электролитов Растворы сильных электролитовСтраница 2
Здесь C – аналитическая концентрация, z – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
На рис. 6.6 сопоставляются вычисленные и экспериментальные значения lg γ± при различных ионных силах. Из него видно, что уравнение Дебая–Хюккеля выполняется только для разбавленных растворов.
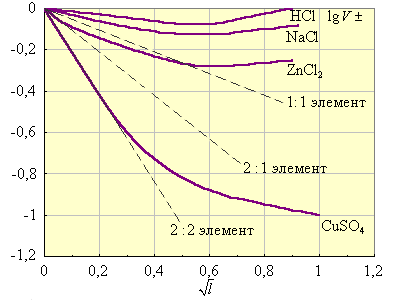 |
|
Рисунок 6.6 Зависимость |
Пунктирные прямые рассчитаны по уравнению Дебая–Хюккеля. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов.
Смотрите также
Общие сведения о спиртах. Полиолы
...
Нефть и технология ее переработки
...
Изучение и анализ производства медного купороса
Целью
данного дипломного проекта является изучение и анализ производства медного
купороса, основанного на переработке отработанного передаточного электролита
цеха электролиза меди.
В
хо ...


