Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Водородный показатель pHОткрытая химия / Растворы / Открытая химия / Растворы / Водородный показатель pH Водородный показатель pH
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
|
|
|
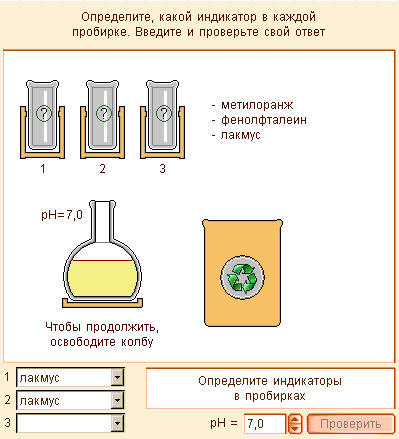
Модель 6.7. Индикаторы |
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3). На рис. 6.5 приведены pH некоторых бытовых растворов и пищевых продуктов.
 |
|
Рисунок 6.5 pH различных веществ и систем |
Смотрите также
Химические свойства и область применения полиэтилентерефталата
Полиэтилентерефталат
(ПЭТФ, ПЭТ)- термопластик, наиболее распространённый
представитель класса полиэфиров, известен под разными фирменными названиями:
полиэфир, лавсан или полиэстер.
Пла ...
Определение термодинамических активностей компонентов бронзы БрБ2
Цель данной
работы – расчёт термодинамических активностей компонентов бериллиевой бронзы
БрБ2. Это является первым шагом на пути к изучению термодинамических свойств
этой бронзы, построению ...
Химические свойства ароматических аминов
Ароматические амины имеют менее выраженный основный характер, чем
алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина ...