Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Растворы слабых электролитовОткрытая химия / Растворы / Открытая химия / Растворы / Растворы слабых электролитов Растворы слабых электролитовСтраница 2
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда (6.1) можно записать в виде
| |
Решая его относительно α, получим
| |
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
|
|
|
Модель 6.6. Реакции кислот и оснований |
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
| ||||||||||||
|
Таблица 6.3 |
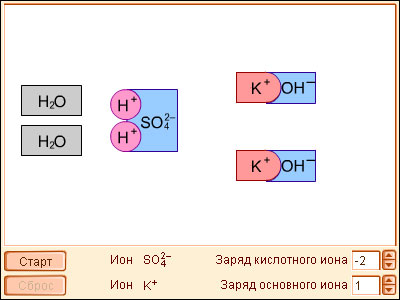
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
| |
ее константа при 298 K равна
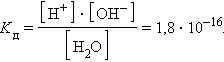 |
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
| |
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
| |
Смотрите также
Механизмы переноса субстанций
...
Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова
данные [25, 26] показывают, что в системах KI - PdI2 –
фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются
развитые релаксацио ...
Определение жесткости воды комплексонометрическим методом
В природных водах
находится очень большое количество различных химических соединений. В процессе
естественного кругооборота природные воды, находясь в контакте с воздухом и
породами земной ...