Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Равновесный состав газа в металлургических реакцияхУчим химию / Учим химию / Равновесный состав газа в металлургических реакциях Равновесный состав газа в металлургических реакцияхСтраница 2
∆G = RT (ln Пр – ln Кр) (4)
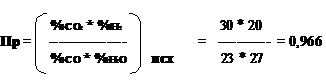
При 700, 800 ° C Кр > Пр ∆G < 0 , прямая реакция
При 900, 1000 ° C Кр < Пр ∆G < 0 , обратная реакция
Температура, при которой исходная смесь находится в равновесии :
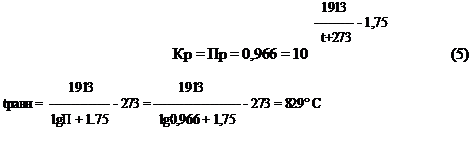
Таблица 1 иллюстрирует влияние температуры на равновесный состав газа. Повышение температуры вызывает увеличение концентрации исходных веществ, т.е. равновесие смещается в обратном направлении. Это характерно для экзотермических реакций. Оценим среднее значение теплового эффекта реакции

Сравнивая это уравнение с уравнением 2, получаем
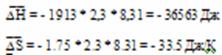
Равновесная температура для исходной смеси может быть найдена и графически:
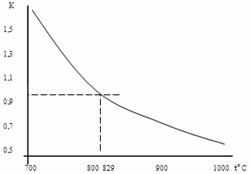
Рисунок 1. К определению равновесной температуры.
Задача №2
Равновесный состав газа в реакции Бела-Будуара
Ств + CO2 = 2СО
Данная реакция имеет место во всех процессах взаимодействия газовой фазы с твердым углеродом в коксохимическом производстве и металлургии. Поскольку система двухкомпонентная и двухфазная, то вариантность:
C = k – f + n = 2 – 2 + 2 = 2
т.е. равновесный состав зависит от 2-х параметров ( Т и Р )
%CO равн = φ (Т,Р)

Преобразуем уравнение №1, получим:
Р * %CO² + Кр * 100%СО - 100² * Кр = 0 (4)
Решение этих уравнений относительно %СО является решением квадратного уравнения. Один из корней этого уравнения положительный, а другой всегда отрицательный и не имеет физического смысла.
Результаты расчетов равновесного состава газа при разных давлениях представлены в таблице №2.
Таблица 2. Равновесный состав газа.
| t° C | Кр | Об. %CO при давлениях (атм.) | ||
| 0,5 | 1,0 | 3,5 | ||
| 402 | 0,0001 | 1,26 | 0,89 | 0,48 |
| 579 | 0,0445 | 27,5 | 19,0 | 10,7 |
| 690 | 0,7152 | 67,8 | 56,1 | 36,1 |
| 829 | 10,53 | 95,7 | 92,0 | 79,2 |
| 936 | 54,74 | 99,1 | 98,2 | 94,3 |
Данные расчета представлены на рисунке №2
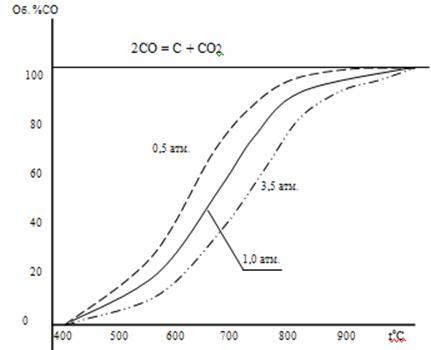
Рисунок 2. Равновесный состав газа при разных давлениях.
Из таблицы 2 и рисунка 2 следует, что повышение температуры вызывает увеличение %СО, т.е. смещение равновесия реакции вправо, что характерно для эндотермических процессов.
Смотрите также
Заключение
Целью
проведенного исследования являлось комплексное спектроскопическое исследование
каменной соли Соликамского и Польского месторождений и разработка модели
природного синего окрашивания.
Крист ...
Потенциометрическое титрование и обработка результатов.
Общие
указания при потенциометрическом титровании применимы для большинства
потенциометрических титрований, но в отдельных случаях можно вносить небольшие
изменения.
1. &n ...
Д. И. Менделеев
Свою мини творческую работу я хотел
бы начать с причин, которые подтолкнули меня к её написанию.
Во-первых, до написания этой работы я
знал о Дмитрии Ивановиче только то, что он был Велик ...


