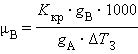Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Законы РауляСтраница 2
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
|
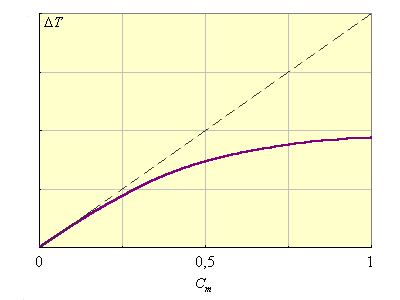
Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества, где выполняется этот закон, на Cm (B) = 1, где этот закон уже не действует (рис. 6.3). В табл. 6.2 приведены Kкр и Kэф для воды и бензола.
 |
|
Рисунок 6.3 Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы Kкр и Kэб |
| |||||||||
|
Таблица 6.2 Криоскопические и эбулиоскопические константы для воды и бензола (град∙моль–1∙кг) |
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:
|
Смотрите также
Описание технологического процесса получения грунтовки водно-дисперсионной глубокого проникновения
...
Основы косметической химии
...
Реакции фенолов
Фенолы могут реагировать как
по гидроксильной группе, так и по бензольному кольцу.
...