Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Коррозия технических металловУчим химию / Теоретические основы электрохимической коррозии / Учим химию / Теоретические основы электрохимической коррозии / Коррозия технических металлов Коррозия технических металловСтраница 4
ic = i0H℮-(kηH(1 – α)F)/RT = i0M℮(aηMα2zF)/RT , (10)
где kηH и aηM - соответственно катодная поляризация при выделении водорода и анодная поляризация при растворении металла;
(1— α) и α2 — коэффициенты переноса для реакции выделения водорода и растворения металла;
z — валентность металла.
Обозначим (1—α) через α2 и снимем индексы к и а у величины поляризации. Водородное перенапряжение в условиях коррозии равно разности между стационарным коррозионным потенциалом и обратимым потенциалом водородного электрода в данных условиях (уравнение 11):
ηH = εc - Hεr (11)
Аналогичное уравнение справедливо для анодной поляризации металла (уравнение 12).
ηМ = εc - Мεr (12)
Подставив в уравнение 10 вместо ηH и ηМ их значение из уравнения 11 и 12, решим полученное уравнение относительно стационарного потенциала коррозии (уравнение 13).
εc = 2.303 ![]() (13)
(13)
Подстановка этого значения εc в уравнение 10 после несложных преобразований приводит к уравнению 14.
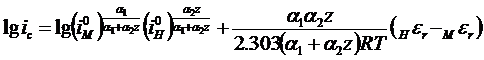 (14)
(14)
Уравнения 13 и 14 позволяют рассчитать величину потенциала металла в условиях его коррозии, а также скорость коррозионного разрушения, если только известны токи обмена, коэффициенты переноса и равновесные потенциалы анодной и катодной реакций.
Поляризационная диаграмма на рисунке 5, так же как и уравнения 13 и 14, относятся к тому случаю, когда скорость коррозии определяется чисто кинетическими ограничениями, то есть химической поляризацией. Это отвечает коррозии с водородной деполяризацией.
Другим важным случаем электрохимического разрушения металлов является их коррозия с кислородной деполяризацией. В связи с малой растворимостью кислорода в водных средах, а также в связи с тем, что его коэффициент диффузии значительно меньше коэффициента диффузии ионов водорода, скорость коррозии с кислородной деполяризацией обычно определяется диффузией. На рисунке 5 в упрощенном виде представлена типичная поляризационная диаграмма процесса коррозии с кислородной деполяризацией.
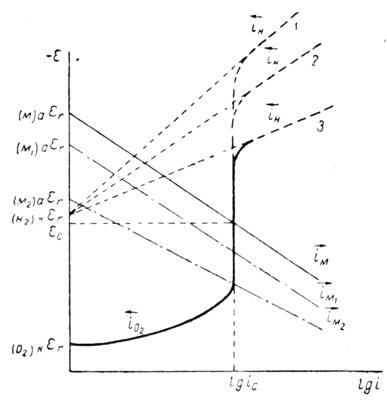
Рисунок 5 - Упрощенная поляризационная диаграмма процесса коррозии с кислородной деполяризацией
Скорость коррозии в этом случае оказывается равной предельному току диффузии кислорода к поверхности корродирующего металла (уравнение 15).
ic = 2oid (15)
Скорость коррозии с кислородной деполяризацией поэтому почти не зависит (в известных пределах) от природы растворяющегося металла, в частности от величин его равновесного потенциала и анодной поляризации. В этом легко убедиться, если построить коррозионные диаграммы для трех различных металлов М, M1 и М2 (штрих-пунктирные линии на рисунке 5). На коррозию с кислородной деполяризацией может накладываться коррозия за счет выделения водорода, если равновесный потенциал водородного электрода в данном растворе положительнее равновесного потенциала корродирующего металла (прямые 1, 2 и 3 на рисунке 5). Величина предельного тока определяется растворимостью кислорода и величиной его коэффициента диффузии, но не зависит от природы металла, на котором восстанавливается кислород. В результате этого скорость процесса коррозии с кислородной деполяризацией меньше зависит от степени чистоты металла, чем скорость процесса коррозии с водородной деполяризацией, и изменяется в более широких пределах при изменении условий размешивания раствора и способа подвода кислорода [1,3-5].
Смотрите также
Функциональные замещенные алициклических и ароматических соединений
...
Химическая связь
Химическая связь
– это взаимодействие, которое связывает отдельные атомы в молекулы, ионы,
радикалы, кристаллы.
Основным условием
образования химической связи является понижением полной ...


