Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Условия возникновения коррозионного процессаУчим химию / Теоретические основы электрохимической коррозии / Учим химию / Теоретические основы электрохимической коррозии / Условия возникновения коррозионного процесса Условия возникновения коррозионного процессаСтраница 1
Коррозия металлов представляет собой частный случай неравновесных электродных процессов; в то же время ей свойственны некоторые особенности, отличающие ее от других неравновесных электродных процессов. Для протекания коррозионного процесса совсем не обязательно наложение внешнего тока и тем не менее растворение металла в условиях коррозии совершается со скоростями, сравнимыми с теми, какие наблюдаются при растворении металлических анодов в промышленных электролизерах.
Если кусок какого-либо металла М приведен в контакт с водным раствором его соли МА, то через некоторое время на границе между металлом и раствором устанавливается значение потенциала, которое в дальнейшем будет сохраняться почти неизменным. Эта постоянная, или почти постоянная, величина может отвечать установившемуся равновесию между металлом и раствором или стационарности электродного процесса. Какой из этих двух случаев реализуется в действительности, определяется, в первую очередь, самой величиной электродного потенциала. Если термодинамический электродный потенциал металла имеет величину, при которой в данных конкретных условиях исключено протекание всех других процессов, (кроме обмена металлическими ионами между металлом и раствором), то установившаяся величина потенциала отвечает его равновесному значению в данных условиях. Скорость переходов ионов металла в двух противоположных направлениях выравнивается при достижении состояния равновесия и становится равной току обмена (уравнение 1 ), а установившееся значение потенциала отвечает его термодинамической величине.
![]() (1)
(1)
Примером таких систем может служить серебро, опущенное в раствор нитрата серебра.
Положение существенно меняется, если термодинамический электродный потенциал металла имеет величину, при которой наряду с ионизацией и разрядом ионов металла возможен хотя бы один дополнительный электродный процесс. В этом случае заряды через границу раздела между металлом и раствором переносятся уже не одним, а двумя сортами частиц. Установившееся постоянное значение потенциала не обязательно свидетельствует о достижении равновесного состояния. Оно указывает лишь на то, что суммарное число зарядов, переходящих через границу в одном направлении, равно суммарному числу зарядов, пересекающих ее в обратном направлении (уравнение 2):
![]() (2)
(2)
Если предположить, что дополнительным электродным процессом будет выделение и ионизация водорода, так называемая коррозия с водородной деполяризацией, то вместо уравнения 2 можно написать уравнение 3:
![]() , (3)
, (3)
где индекс М относится к металлу, а индекс Н — к водороду.
Когда скорости всех частных процессов сравнимы и ни одной из них в уравнении 3 пренебречь нельзя, тогда установившаяся величина потенциала не отвечает ни потенциалу металлического электрода первого рода (или металлического электрода второго рода, что возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. Это будет некоторая компромиссная величина, зависящая от соотношения скоростей всех частных реакций (рисунок 1).
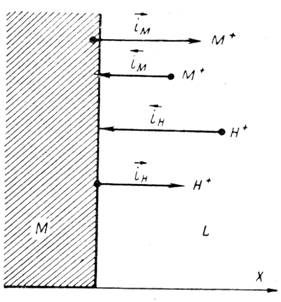
Рисунок 1 - Схема установления компромиссного или стационарного коррозионного потенциала при сравнимых скоростях катодной и анодной реакций:
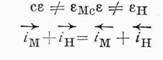
Однако могут быть такие случаи, когда потенциал данного электрода не очень сильно отличается или от потенциала водородного электрода, или от потенциала соответствующего металлического электрода. Действительно, хотя частные токи в уравнении 3 не отвечают токам обмена в состоянии равновесия, они все же должны изменяться параллельно с величинами последних. Поэтому, если ток обмена металла i0M значительно больше тока обмена водорода i0Н, то с известным приближением можно допустить, что
![]() и
и ![]() .
.
Тогда вместо уравнения 3 можно написать в виде уравнения 4:
![]() (4)
(4)
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста.
Смотрите также
История открытия редких химических элементов
Элементы побочной подгруппы 3-ей группы и семейство, состоящих из 14 F-элементов с порядковыми номерами от 58 до 71,
весьма близки к друг другу по своим химическим и физико-химическим свойств ...
Заключение
29Cu – Медь
[Ar]3d104s1
Древние цивилизации оставили нам множество
изделий из бронзы.
Атомная
масса: 63,54
Электроотрицательность:
1,9
Тпл:
10 ...
Фуллерены
...


