Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электронная структура ацетальдегидаУчим химию / Получение уксусной кислоты / Учим химию / Получение уксусной кислоты / Электронная структура ацетальдегида Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с < 2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С-О-связей (2• 358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы - около 9•10-30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. [16, с. 166]
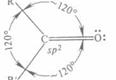
Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3
Электронная структура кислорода
Кислород О имеет электронную конфигурацию невозбужденного атома
![]()
Is-2s22p4:
В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать следующими структурными формулами:
![]()
Тремя точками обозначены связи, обусловленные двумя πсв- и одним πразр-электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают πразр-электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).[17, с. 337]
Смотрите также
Расчет и проектирование выпарной установки непрерывного действия для выпаривания водного раствора CuSO4
Выпаривание –
процесс концентрирования растворов нелетучих веществ путем удаления жидкого
летучего растворителя в виде паров. Сущность выпаривания заключается в переводе
растворителя в паро ...
Технология производства аскорбиновой кислоты (витамина С)
Аскорбиновая кислота впервые выделена
в чистом виде Сцент-Гиорги в 1928 г. под названием гексуроновая кислота. В 1933 г. рядом исследователей установлена ее структура. Синтез ее осуществлен в ...


