Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Принцип полярографического методаУчим химию / Учим химию / Принцип полярографического метода Принцип полярографического методаСтраница 2
Сдвиг потенциала (по сравнению с его равновесным значением при отсутствии тока), происходящий вследствие изменения концентрации потенциалопределяющих ионов у электродов в процессе электролиза, характеризует величину концентрационной поляризации.
Омическая поляризация обусловлена образованием на поверхности электрода тонкой пленки, состоящей из оксидов, гидроксидов металлов или адсорбированных молекул органических веществ (при исследовании растворов органических соединений).
Величина омической поляризации равна RI, где R — электросопротивление пленки, a t — сила тока.
Полярографический метод основан на определении зависимости силы тока от потенциала при электролизе) раствора исследуемого вещества в определенных условиях, в специальном электролизере.
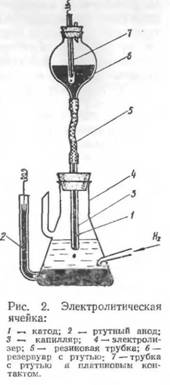
Основная часть полярографа представляет собой электролитическую ячейку, состоящую из сосуда, наполненного раствором анализируемого вещества, и двух ртутных электродов (рис. 2). Анодом является ртуть, заполняющая дно сосуда; катодом — капли ртути образующиеся на конце капиллярной трубки, заполненной ртутью. Под влиянием собственной тяжести капля ртути падает на дно сосуда, после чего образуется новая капля и т.д. Таким образом, катодом является непрерывно возобновляющаяся капля ртути.
При прохождении через раствор даже небольшой силы тока (106 а) благодаря малой поверхности, а следовательно, большой плотности тока на ртутной капле, происходит химическая поляризация катода за счет восстановления ионов или молекул исследуемого вещества на поверхности электрода. В результате электрохимического восстановления на поверхности ртутной капли образуется вещество, при этом потенциал катода ек определяется соотношением концентраций исходного и восстановленного вещества и является характерным для данной реакции.
Так как площадь ртутного анода большая, а плотность тока на нем мала, то химические явления не способны изменить электродный потенциал анода еа, поэтому потенциал анода практически сохраняется неизменным.
Таким образом, при прохождении тока через описанную ячейку, когда протекает непрерывный электролиз, возникает электродвижущая сила поляризации, равная £п = еа — ек, направленная навстречу приложенному напряжению Е. Если учесть омическое сопротивление, то сила тока по закону Ома равна:
![]()
отсюда![]()
где R — сопротивление раствора между электродами. Поскольку сопротивление Я раствора обычно не превышает 100 ом, то произведение IR очень мало (Ю-6 -100= =0,1 мв); в таком случае можно считать, что IR^O, следовательно:![]()
Принимая постоянный потенциал анода условно за нуль, получим выражение:![]()
показывающее, что все приложенное напряжение Е уравновешивается потенциалом поляризации катода. Поэтому такой ртутный электрод называют абсолютно поляризующим. Потенциал его зависит от природы восстанавливающегося на нем иона или вещества.
Зависимость «сила тока — потенциал» выражается обычно графически в виде поляризационных кривых (полярограмм). Величины потенциалов в вольтах (или милливольтах) откладываются на оси абсцисс, а соответст-
Смотрите также
Радиоактивный анализ
Радиоактивный
анализ открыл в конце XIX столетия (в 1895 г.) немецкий физик Вильгельм Конрад Рентген невидимые
лучи способные беспрепятственно проходить через твёрдые тела и вызывать
почерн ...
Йод
ИОД (лат. Iodium), I - химический элемент VII
группы периодической
системы Менделеева, относится к галогенам (в литературе
встречается также символ J); атомный номер 53, атомная масса 126, ...
Сравнение изотермического реактора идеального вытеснения и реактора полного смешения в зависимости от степени превращения
Серная кислота
является одним из крупнотоннажных продуктов химической технологии. Серная кислота
относиться к числу сильных кислот и является самой дешёвой. Она реагирует почти
со всеми мет ...


