Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория
ковалентной связи. Метод молекулярных орбиталей (МО).Учим химию / Применение ЭВМ в технологии лекарственных препаратов / Учим химию / Применение ЭВМ в технологии лекарственных препаратов / Теория
ковалентной связи. Метод молекулярных орбиталей (МО). Теория
ковалентной связи. Метод молекулярных орбиталей (МО).Страница 1
Метод МО начал разрабатываться в 30-х годах ХХ века в работах ряда ученых (Гунд, Малмекен и др.). В этом методе каждый электрон рассматривается движущимся в поле всех электронов и всех ядер молекулы. Как и в других методах квантовой химии при этом используется одноэлектронное приближение, согласно которому каждый электрон описывается отдельной волновой функцией, а из них составляется полная волновая функция молекулы. Одновременно учитывается адиабатическое приближение Борна-Оппенгеймера
; движение электронов молекулы ввиду относительной замедленности колебательных движений массивных ядер рассматривается в поле фиксированных ядер.
Для построение молекулярных орбиталей используется вариант метода, называемый линейной комбинацией атомных ордиталей – молекулярные орбитали (ЛКАО – МО)
. В его основе лежит способ получения одноэлектронных молекулярных орбиталей (МО) в виде линейной комбинации атомных орбиталей (ЛКАО). Если по-прежнему для двухатомной молекулы (например, Н2) обозначить волновые функции атомов φа и φb (атомные орбитали), то в общем виде их линейные комбинации будут описывать движение каждого электрона в молекуле следующим образом:
![]() ,
,
где і – номер МО;
j – номер АО;
сj – изменяемые параметры, учитывающие долю каждой из суммируемых орбиталей (находятся из условия минимума энергии).
Далее в методе МО допускается, что волновая функция, описывающая состояние многоатомной молекулы, может быть представлена как произведение волновых функций одноэлектронных МО:
ψI = ψ1ψ2 = [φa(1) + φb(1)] [φа(2) ∙ φb(2)].
Таким образом, состояние молекулы Н2 в методе МО определяется совокупностью ряда слагаемых:
ψI = φa(1)∙φb(2) + φа(2)∙φb(1) + φа(1)∙φа(2) + φb(1)∙φb(2)
Сравнение последнего соотношения с применявшимися в методе ВС функциями ψ± показывает, что в методе МО волновая функция ψI отличается третьим и четвертым членом. Оба эти члена характеризуют случаи, когда два электрона находятся либо у одного, либо у другого ядра, т.е. соответствуют ионным состояниям молекулы На- – Нb+ и На+ – Нb-. В действительности роль таких состояний в характеристике МО невелика и составляет около 6 % от энергии обменного взаимодействия, которым определяется ковалентная связь.
Последующие расчеты в методе МО, как и в методе ВС, направлены на определение энергии системы. Здесь так же, как и в методе ВС, получают два значения (уровня) энергии. Первый уровень отвечает соединению атомов и образованию химической связи, поэтому первая орбиталь называется связывающей
. Второй уровень характеризует отталкивание, и соответствующая орбиталь называется разрыхляющей
. Схема образования химической связи в молекуле Н2 в методе МО изображена на рис. 2.
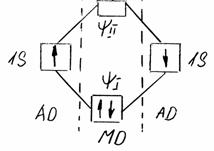
Рис. 2. Схема образования ковалентной связи в Н2.
На рисунке показано, что образование химической ковалентной связи происходит за счет спаривания двух электронов с противоположной ориентацией спинов. Ячейка, соответствующая состоянию этих электронов, расположена ниже ячеек АО, так как энергия МО ψІ меньше, чем у исходных АО. В то же время энергия МО ψІІ больше и ячейка свободна от электронов. При возбуждении молекулы и появлении на верхней МО так называемых разрыхляющих электронов система распадается на отдельные атомы.
Смотрите также
Химизм токсичности металлов
Отравления соединениями тяжелых металлов известны с
древних времен. Упоминание об отравлениях «живым серебром» (сулема) встречается
в IV веке. В середине века сулема и мышьяк были наиболее р ...
Полимераналогичные превращения хитозана
Макромолекула
хитозана является линейной и не содержит ни поперечных связей, ни разветвлений.
Изучению свойств и химических реакций хитозана посвящено много работ. Наиболее
полные данные пр ...
Приготовление сорбентов и колонок для высокоэффективной жидкостной хроматографии
...


