Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Основы
квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.Учим химию / Применение ЭВМ в технологии лекарственных препаратов / Учим химию / Применение ЭВМ в технологии лекарственных препаратов / Основы
квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера. Основы
квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.Страница 2
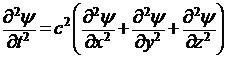 , (6)
, (6)
После исключения t (с помощью (3)) волновое уравнение примет вид:
![]() , (7)
, (7)
где ψ – так называемая волновая функция
– величина, периодически изменяющаяся по закону гармонического движения;
ν2 – оператор Лапласа, означающий, что над функцией производится следующее действие:
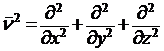 .
.
Будем считать, что волновое уравнение (7) описывает движение частицы. Тогда λ
– длина фазовой волны
, а ψ
– амплитуда фазовой волны
в любой произвольно взятой точке χ, y, z, характеризующей местоположение частицы. Длину и амплитуду фазовой волны можно связать с массой и энергией частицы. Если частица движется в потенциальном поле, то ее полная энергия Е складывается из кинетической энергии Ек = mV2/2 и потенциальной энергии Еп. Отсюда
½mV2 – Е – Еп или m2V2 = 2m(E – Eп).
Учитывая соотношение де Бройля, запишем
m2V2 = h2/λ2 и λ2 = h2/2m (E – Eп)
и представим волновое уравнение в следующем виде:
![]() (8)
(8)
В этой форме волновое уравнение называется уравнением Шредингера
. Оно является основным уравнением квантовой механики.
Уравнение Шредингера – дифференциальное уравнение в частных производных и может иметь множество решений. Однако физический смысл имеют лишь те ψ-функции (так называемые собственные функции
), которые удовлетворяют ряду условий. Во-первых, эти функции должны быть непрерывными, конечными, однозначными и обращаться в нуль на бесконечном расстоянии. Наложение перечисленных условий называется нормированием ψ-функции. Во-вторых, собственным ψ-функциям соответствуют не любые, а только дискретные значения полной энергии Е. Как дискретные значения энергии, так и вид собственных ψ-функций определяется совокупностью квантовых чисел n, l, m, которые хотя и не содержатся в самом уравнении Шредингера, но вводятся в него при решении. Таким образом, квантование энергии естественно и неизбежно вытекает из основных свойств материальных объектов и не нуждается в особом постулировании, которое было сделано Н. Бором при разработке планетарной модели атома.
Смотрите также
Исследование фазовых эффектов в бинарных азеотропных смесях
...
Занимательные опыты по химии
...
Наркотические и психотропные вещества
Злоупотребление
наркотическими средствами и незаконная торговля ими в последнее время во
многих, особенно развитых странах мира, приняли катастрофические размеры.
Официальная пресса США, Ге ...


