Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диметилглиоксим (диацетилдиоксим, реактив Чугаева)Учим химию / Применение органических реагентов в аналитической химии / Учим химию / Применение органических реагентов в аналитической химии / Диметилглиоксим (диацетилдиоксим, реактив Чугаева) Диметилглиоксим (диацетилдиоксим, реактив Чугаева)
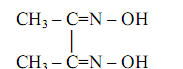
Это – классический органический реагент, впервые предложенный, как уже отмечалось, Л.А. Чугаевым в 1905 году в качестве специфического селективного реагента на никель.
Ионы Ni2+ образуют с диметилглиоксимом в водной среде объёмистый осадок красного цвета, малорастворимый в воде и в водном аммиаке, но растворимый в минеральных кислотах. Реакция протекает по схеме:
Ni2+ + HDMG→ [Ni(DMG)2] + 2Н+
где HDMG – сокращённое обозначение молекулы диметилглиоксима. Структурная формула образующего комплекса будет выглядеть следующим образом:
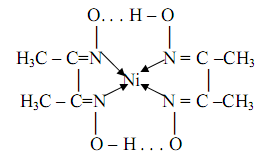
где точками обозначены внутримолекулярные водородные связи. Этот нейтральный комплекс никельдиметилглиоксим и является показателем наличия ионов никеля в растворе. Осаждение обычно проводят из разбавленных аммиачных растворов при рН=8-9. Комплекс очень устойчив; логарифм константы устойчивости равен lgβ=17, 32. Реакция весьма чувствительна: предел обнаружения m=0, 16 мкг, предельное разбавление Vlim =3∙105 мл/г. Поскольку диметилглиоксим малорастворим в воде, то предложено использовать не сам диметилглиоксим, а его двунатриевую соль, которая растворяется в воде. С помощью диметилглиоксима можно определять также и палладий(II), железо(II), висмут(III), кобальт(III). При определении никеля для устранения мешающего действия висмута, железа и кобальта ионы последних маскируют введением тиогликоевой кислоты. Небольшое количество ионов кобальта и железа можно также маскировать введением винной кислоты. Для маскирования больших количеств этих ионов рекомендуют прибавлять в раствор добавки N,N-ди(оксиэтилен)глицина. Диметилглиоксим используют и при фотометрическом определении никеля в присутствии окислителей.
Смотрите также
Определение лигнина
Содержание лигнина в древесине и другом
растительном сырье преимущественно определяют прямыми способами. Они основаны
на количественном выделении лигнина удалением экстрактивных веществ
соо ...
Вычисление теплового эффекта реакций
Вычислить тепловой эффект реакции при стандартных
условиях: Fe2O3 (т) + 3 CO (г)
= 2 Fe (т) + 3 CO2 (г),если теплота образования: Fe2O3
(т) = – 821,3 кДж/моль;СО(г) = – 110,5 кДж/моль;
...


