Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Классификация химических реакций по различным признакамУчим химию / Понятие химических реакций и их классификация / Учим химию / Понятие химических реакций и их классификация / Классификация химических реакций по различным признакам Классификация химических реакций по различным признакамСтраница 1
Разнообразие химических реакций, количество которых не поддается подсчетам, невозможно охватить единой универсальной классификацией, поэтому их разделяют по определенным общим признакам. Под любой из таких признаков могут быть отнесены реакции, как между неорганическими, так и между органическими веществами.
Во-первых, это реакции без изменения состава вещества
и реакции с изменением состава.
Реакции, идущие без изменения состава веществ:
3 О2 = 2 О3
AlCl3,t
СН3-СН2-СН2-СН3 → СН3-СН-СН3
|
C
Н3
Реакции, идущие с изменением состава веществ:
6 СО2 + 6 Н2О = С6Н12О6 + 6 О2
В органической химии к этому типу реакций относятся реакции изомеризации. Так, изомеризацию алканов проводят для получения бензина с большим октановым числом.
Для химических процессов, происходящих между неорганическими реагентами, наиболее часто используются такие классификации:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта
Различные способы классификации часто сочетаются друг с другом (рис.1).
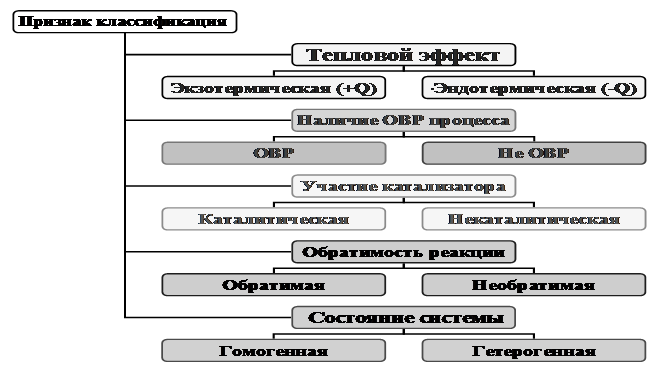
Рисунок 1 – Признак классификации химических реакций
Рассмотрим более подробно каждый из типов химических реакций.
1. Классификация по числу и составу реагентов и конечных веществ (табл.1).
Таблица 1 - Типы химических реакций и их механизмы
|
Химические реакции соединения |
Химические реакции разложения |
Химические реакции замещения |
Химические реакции ионного обмена |
|
A + B = AB Из нескольких простых или сложных веществ образуется одно сложное |
AB = A + B Из сложного вещества образуется несколько простых или сложных веществ |
A + BC =AC + B Атом простого вещества замещает один из атомов сложного |
AB+CD = AD+CB Сложные вещества обмениваются своими составными частями |
1. Реакции соединения. Д.И.Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Итак, при реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава
A
+
B
+
C
=
D
К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений - являются экзотермическими.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности
СаСО3 + СО2 + Н2О = Са (НСО3)2
так и относиться к числу окислительно-восстановительных
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения. Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число.
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества
А = В + С + D
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества. Примером реакции разложение может служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т.е. протекают с поглощением теплоты. Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот
Смотрите также
Органические красители
Понятие
«красящее вещество» подразумевает возможность окрашивания любого субстрата. #
хранения волокон, подкрашивание пищевых продуктов (пищевые пасты, сливочное
масло и т.д.) все окрашенны ...
Красители на основе 2-амино-5-меркапто-1,3,4-тиадиазола
Красителями, в широком смысле этого слова, называют
органические соединения, обладающие способностью поглощать и преобразовывать
световую энергию в видимой и ближних ультрафиолетовой и инфра ...
Определение оптимальных рабочих параметров процесса экстрактивной ректификации смеси ацетон-хлороформ в сложной колонне с боковой секцией
Ацетон
и хлороформ входят в состав смеси растворителей, применяемых в производстве термостабилизатора
стабилина-9. Для их регенерации
в [1] было предложено использовать экстрактивную ректиф ...


