Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Получение этилена дегидратацией
этанола над оксидом алюминияУчим химию / Получение метана и опыты с ним / Учим химию / Получение метана и опыты с ним / Получение этилена дегидратацией
этанола над оксидом алюминия Получение этилена дегидратацией
этанола над оксидом алюминия
Описанный выше опыт получения этилена дегидратацией этанола в присутствии H2SO4 (конц) приводит к образованию большого количества оксида серы (IV) и множества других токсичных соединений, опасных для окружающей среды. Оксид серы (IV) очень быстро обесцвечивает раствор KMnO4 и бромную воду, что делает некорректным описанный опыт в целях учебной демонстрации: C2H5OH + 2H2SO4 = 2C+2SO2 + 5H2O, далее:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O (при нагревании)
5SO2+2KMnO4+2H2O = K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O = H2SO4+2HBr
Более простой и экологически чистый вариант получения этилена основан на пропускании паров спирта над нагретым твердым катализатором из оксида алюминия.
Оборудование и реактивы: Демонстрационная круглодонная пробирка, стеклянные и резиновые газоотводные трубки, две U-образные трубки, пробирки, стеклянная трубка с оттянутым концом, штатив, лапка штатива, спиртовка, лучинка, этанол, промытый и прокаленный песок, катализатор из глины в смеси с оксидом аллюминия, вода дистиллированная.
Ход работы: Готовят катализатор. Для этого накануне занятия смешивают глину с оксидом алюминия в соотношении 2:1, смачивают водой, хорошо перемешивают и выкатывают из них горошины, которые сушат на воздухе.
В демонстрационную пробирку (1) насыпают сухой песок (3-4 см. высотой) и пропитывают его спиртом. Поверх песка помещают катализатор почти до краев пробирки. Пробирку-реактор закрепляют в лапке штатива с небольшим наклоном (дно выше отверстия) и соединяют с двумя U-образными трубками (рис.3). Тщательно прогревают катализатор, затем другой спиртовкой нагревают песок, смоченный спиртом так, чтобы постоянно в емкости имелись пары спирта (не перегревать!). В данных условиях кроме этилена может получаться и бутадиен, который ставит под сомнение корректность опыта. Для поглощения бутадиена в первую U-образную трубку (2) наливают этанол. Растворимость бутадиена в спирте 15 мл на 100 мл растворителя. Весь бутадиен остается в спирте, так как газовая смесь, выходящая из первой U-образной трубки, не дает розовой окраски с раствором качественного реактива на бутадиен - хинона.
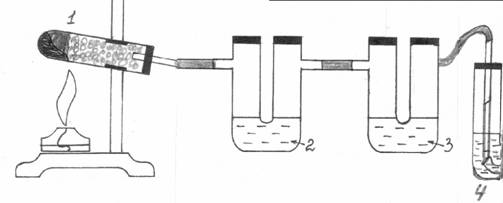
Рис. 3. Получение этилена дегидратацией этанола над твердым катализатором.
Другая U-образная трубка (3) заполняется спиртом или водой для получения раствора этилена. Растворимость этилена в воде и спирте 25,6 и 360 мл на 100 мл растворителя соответственно. Таким образом, можно получить раствор этилена в воде и спирте, которые используют для определения непредельных органических веществ.
Отросток последней U-образной трубки соединяют с газоотводной трубкой, которую помещают в пробирку (4) вначале с бромной водой, а затем с раствором перманганата калия. Наблюдают обесцвечивание растворов. Перед окончанием опыта к газоотводной трубке присоединяют стеклянную трубку с оттянутым концом. Поджигают этилен пламенем лучинки. Наблюдают горение этилена светящимся пламенем. Написать уравнения реакций.
Техника безопасности. 1. Демонстрационная пробирка-реактор прогревается равномерно во избежание растрескивания и возгорания газообразных веществ, образующихся в пробирке. 2. Подставить противень с песком под нагреваемую пробирку. 3. Установка должна быть герметичной.
Утилизация. Раствор бутадиена и этилена в спирте использовать в спиртовках, а также для демонстрации их непредельного характера Обесцвеченный раствор KMnO4 и бромную воду утилизировать согласно прописям в предыдущем опыте.
Смотрите также
Губчатые изделия
Тема данной курсовой работы «Губчатые изделия», эта тема довольно
актуальна, так как производство губчатых изделий занимает не маловажное место в
промышленности. Потому что эти изделия имеют ...
Кинетика химических реакций.
Цель работы - изучение
скорости химической реакции и ее зависимости от различных факторов: природы
реагирующих веществ, концентрации, температуры.
Учение о
скорости химической реакции называетс ...


