Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Методика проведения экспериментаУчим химию / Получение медноаммиачного волокна (целлюлозы) химическим методом / Учим химию / Получение медноаммиачного волокна (целлюлозы) химическим методом / Методика проведения эксперимента Методика проведения эксперимента
Приготовление реактивов.
Для приготовления медноаммиачного комплекса Cu(OH)2 + 4NH3→Cu(NH3)4(ОН) 2 с лучшим растворением целлюлозы, приготовим несколько растворов:
1) приготовление Cu(OH)2.+ NH3
В одной емкости приготовили насыщенный раствор Na(OH) (ЧДА), во второй – раствор CuSO4. При перемешивании раствора щелочи, по немногу добавляем раствор CuSO4 до достижении густого раствора (выпадает светло зеленый Cu(OH)2). После, через двойную фильтровальную бумагу, на вакуум фильтре, отфильтровуем раствор для извлечении кристаличного Cu(OH)2.
Затем, трижды промываем в дистилированой воде и сушим в сушильном шкафу. В результате этого реактив темнеет, это свидетельствует о его не стабильной форме (распадается на СuO и H2O).
2) приготовление Cu(OH)2 + NH3 без образования СuO.
Приготовление ведут аналогичным образом, но при добавлении раствора щелочи в раствор сульфата, ему даю преждевременно остыть, дабы не вызвать переход к оксиду от воздействия высокой температуры. Отфильтрованный реактив не подвергался сушке в сушильном шкафу.
3) приготовление CuSO4 NH3. Сульфат уже готовый, квалификации ЧДА(CuSO4х5H2O).
Концентрацию NH3 выбираем из приведенной литературы [1] = 25%
В качестве целлюлозы использовалась хлопковая вата.
Три раствора были иставлены на время, после чего отфильтрованы. Было установлено что из трех приготовленных растворов лучше в себе растворяет целлюлозу 3-ий.
Для раствора №3 была снята pH характеристика для определения концентрации NH3 в растворе. Снятие характеристики проводилась следующим образом:
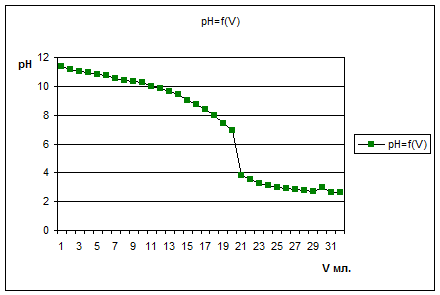
В стакан поместили 5 мл. раствора отфильтрованного [Cu(NH3)4(ОН) 2] + целлюлоза и довели объем до 50 мл. После, при перемешивании магнитной мешалкой по каплям добавляли Н2SO4 концентрацией 1 моль/мл. Была снята характеристика pH=f(V).
Из графика видно, что расход серной кислоты 1 моль/мл
в точке эквивалентности рамен 20,5 мл.
Смотрите также
Заключение.
1. Определены
частные фазовые эффекты для бинарных азеотропных смесей при постоянных давлении
и температуре.
2. Определены
общие и частные фазовые эффекты в азеотропной точке, а так ...
Свойства титана и его соединений
Титан находится в побочной
подгруппе четвертой группы, следовательно относится к переходным элементам.
Переходные элементы обладают определенными схожими свойствами.
Общая характеристика
...
Химическое и адсорбционное
равновесие.
Цель работы - изучение
влияния различных факторов на химическое равновесие, изучение зависимости
величины адсорбции от равновесной концентрации адсорбата.
Понятие
"химическое равновесие&q ...


