Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
О растворимости полиарилатов на основе фенолфталеина и дикарбоновых кислотУчим химию / Учим химию / О растворимости полиарилатов на основе фенолфталеина и дикарбоновых кислот О растворимости полиарилатов на основе фенолфталеина и дикарбоновых кислотСтраница 1
Процесс растворения сопровождается разрушением структуры полимера, растворителя и возникновением новой структуры раствора [1]. В последнее время этому вопросу уделяется большое внимание. Структуру концентрированных растворов полимеров изучали в работах [2—4]. В данной работе при исследовании свойств разбавленных растворов полиарилатов рассматривали два фактора: конформации макромолекул в растворе и ориентациоиный порядок сольватирующих их молекул растворителя, о котором судили по термодинамическим параметрам раствора.
На конформацию макромолекул в растворе большое влияние оказывает равновесная жесткость цепи полимера. В данном исследовании попытались проследить, каким образом изменение строения только кислотной компоненты элементарного звена макромолекулы полиарилата скажется на равновесной жесткости его цепи, а следовательно, и на конформации макромолекулы в растворе и на структуре самого раствора. Исследовали полиарилаты следующего строения:
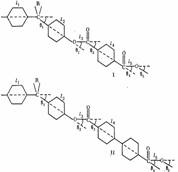
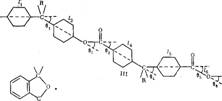
Полиарилаты синтезировали методом высокотемпературной поликонденсации е-среде высококипящего растворителя (а-хлорнафталина) при 220° и продолжительности синтеза 12 ч по методике работы [5]. Фракционирование полимеров на 12-15 фракций проводили методом распределения между двумя несмешивающимися жидкостями, в качестве растворителя использовали смесь тетрахлорэтан (ТХЭ) : фенол в соотношении 3 :1 по весу, осадитель — и-гептан.
ММ фракций и вторые вириальные коэффициенты А2 растворов измеряли методом светорассеяния на фотогониодиффузометре «Fica». Растворы очищали фильтрованием через систему фильтров 3 и 4. Перед измерением интенснвностей светорассеяния кюветы с растворами термостатировали в течение 1 ч в термостате при температуре измерения. Точность термостатирования ±0,1°. Инкремент показателя преломления растворов определяли на рефрактометре типа «Пульфриха», снабженном дифференциальной кюветой.
Растворители очищали по известным методикам [6], чистоту растворителей контролировали по показателю преломления.
Ранее нами было найдено [7], что для полимера I 6-растворителем служит ТГФ (9=22°). Предварительные опыты по температурному осаждению полимеров из раствора показали, что ТГФ можно использовать в качестве О-растворнтеля и для полимера II. Оказалось, что при повышении температуры >20° растворы становились мутными, поэтому 9-температуру искали в температурном диапазоне <20°. Полимер III в ТГФ не растворился. При комнатной температуре этот полимер хорошо растворился в ДХ, а при повышении температуры >45° полимер выпадал в осадок, что свидетельствовало о наличии НКТС. 0-температуры для всех полимеров находили экстраполяцией температурных зависимостей Л2 к 0, используя растворы нефракционированных образцов и фракций.
Температурные зависимости удельных парциальных объемов полимеров в 6-рас-творителях определяли по методике работы [8].
Характеристические вязкости растворов исходных полимеров и их фракций определяли при помощи капиллярного вискозиметра с «висячим» уровнем в ТХЭ при 25±0,1° и в 8-условиях.
Характеристики исследованных образцов и результаты определения 9-условий даны в табл. 1.
Анализ данных по изменению А2 с температурой (рис. 1) свидетельствует о том, что для всех исследованных полимеров характерно ухудшение растворимости с повышением температуры, что подтверждает наличие НКТС. Как известно, НКТС наблюдается в системах с сильными меж-молекулярными взаимодействиями, которые могут быть обусловлены различными причинами, в частности возникновением в растворах донорно-акцепторных связей между макромолекулами полимера и молекулами
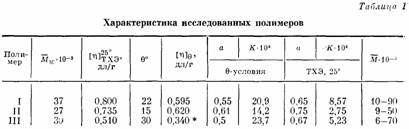
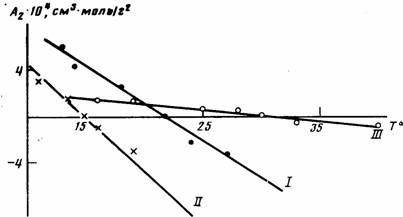
Рис. 1. Температурные зависимости Аг для полиарилатов I—III растворителя [1].
При растворении полимеров I и II в ТГФ возможны такого рода взаимодействия между положительно заряженным атомом углерода карбонильной группы и неподеленными электронными парами атома кислорода в ТГФ. Растворение полиарилата III в ДХ может быть обусловлено донорно-акцепторными взаимодействиями между л-электронами бензольных колец полимера и свободными Зс орбиталями атома хлора растворителя. Полимеры I и II в ДХ также растворимы, однако с повышением температуры их растворимость улучшалась, о чем свидетельствовали данные по температурным зависимостям А2: для полимера I значения А2 изменялись от —2-Ю-4 см3моль/г2 до 1-10-4 см3-моль/г2 в температурном диапазоне 20—35°, для полимера II от —10-10~4 см3-•моль/г2 до 2-10-4 см3-моль/г2 в интервале температур 25—55°.
Смотрите также
Фтор
ФТОР (лат. Fluorum), F - химический элемент
VII группы периодической системы Менделеева, относится к галогенам, атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1 ...
Реакции углеводов
В живой природе широко распространены
вещества, многим из которых соответствует формула Сх(Н2О)у.
Они представляют собой, таким образом, как бы гидраты углерода, что и
обусловило их названи ...


