Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Применение теории регулярных растворов к поверхностному
натяжению и адсорбцииУчим химию / Поверхностное натяжение и адсорбция на границе вода-воздух / Учим химию / Поверхностное натяжение и адсорбция на границе вода-воздух / Применение теории регулярных растворов к поверхностному
натяжению и адсорбции Применение теории регулярных растворов к поверхностному
натяжению и адсорбцииСтраница 1
На основании теории регулярных растворов можно получить соотношение между поверхностным натяжением и адсорбцией второго компонента. Теорию регулярных растворов удобно использовать из-за ее простоты. Конечно, для анализа растворов полимеров можно воспользоваться и теорией Флори-Хаггинса, но в последующих преобразованиях некоторая доля простоты будет утеряна. В теории регулярных растворов принимается, что а) молекулы одинаковы по размеру, б) взаимодействие реализуется только между ближайшими соселями, в) при смешении компонентов не происходит изменения объема. Изменение химического потенциала при смешении двух жидкостей по сравнению с химическими потенциалами каждой индивидуальной жидкости м а ицв выражается как
![]()
и![]()
Параметр зависит от межмолекулярных взаимодействий:
![]()
Поверхность рассматривается как отдельная фаза, находящаяся в равновесии с объемом раствора. Толщина поверхностной фазы принимается равной одной решеточной позиции. Тогда химический потенциал поверхности можно записать как
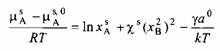
и![]()
где г — поверхностное натяжение раствора. В качестве стандартного состояния принимается состояние поверхностной фазы индивидуальных компонентов. Постоянная а — это площадь поперечного сечения молекулы; ее можно оценить из соотношения
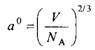
где V— молярный объем, Na — постоянная Авогадро. Параметр чд отличается от соответствующего параметра объемной фазы, поскольку в этом случае отсутствует один решеточный слой. Поэтому зависимость параметра чд от межмолекулярных взаимодействий имеет вид:
![]()
Для гексагональной решетки чд = 0.75ч.
При равновесии фазы раствора с поверхностной фазой их химические потенциалы одинаковы, соответственно получаем:
![]()
![]()
Для индивидуальных компонентов уравнения превращаются в
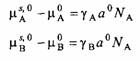
где уд и ув — поверхностные натяжения чистых жидкостей. Таким образом, ясно, что поверхностное натяжение чистой жидкости есть разность химических потенциалов поверхностной и объемной фаз, нормированная на поперечное сечение молекул.
Подставив уравнения в уравнения, получим:
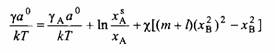 и
и
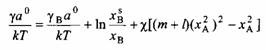
Анализ уравнений и показывает, что изменение поверхностного натяжения не обязательно связано с изменением поверхности. Такие изменения могут быть также обусловлены изменениями в объеме раствора. Водные растворы смесей неорганических электролитов являются примером таких систем. Поскольку электролиты не обладают сродством к поверхности, они накапливаются в объеме раствора, понижая концентрацию растворителя, и, в соответствии с уравнениями, поверхностное натяжение должно увеличиваться. Аналогично, если поверхностное натяжение не изменяется при введении второго компонента, это не означает, что растворенный компонент не адсорбируется на поверхности. Из уравнений следует, что введение второго компонента может приводить к ситуации, когда поверхностное натяжение не меняется, при выполнении следующего условия: растворенное вещество должно приблизительно поровну распределяться между поверхностью и объемной фазой, т. е. Xg /хв *L
Для атермального раствора, т. е. при условии ч = 0, поверхностное натяжение можно легко рассчитать. Используя уравнения, после ряда алгебраических преобразований получим:
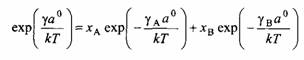
и 
Алгебраическая форма уравнений и идентична уравнениям и соответственно для смешанных мицелл. Величина ехр соответствует KKM. Этот результат не удивителен, поскольку поверхностное натяжение раствора отражает его состав так же, как KKM смеси ПАВ отражает состав смешанной мицеллы. Уравнения указывают на то, что компонент с более низким поверхностным натяжением преимущественно адсорбируется на поверхности. По этой причине поверхностное натяжение раствора всегда ниже среднеарифметического поверхностного натяжения индивидуальных компонентов. Комбинируя уравнения и и исключая поверхностное натяжение раствора, получим уравнение изотермы адсорбции, которое устанавливает связь между составом поверхности и составом раствора:
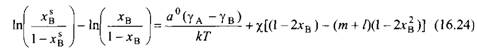
Если пренебречь взаимодействиями между молекулами растворителя и растворенного вещества, полагая, что ч = чд = 0, уравнение принимает вид
Смотрите также
Cложные эфиры
...
Общая и неорганическая химия
...
Получение аллилового спирта гидролизом хлористого аллила
Непредельные спирты - это производные непредельных
углеводородов, в молекулах которых водородный атом замещен на гидроксильную
группу. Непредельные спирты сильно отличаются по свойствам от у ...


