Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические свойства альдегидов и кетонов. Реакции окисления и восстановленияУчим химию / Учим химию / Химические свойства альдегидов и кетонов. Реакции окисления и восстановления Химические свойства альдегидов и кетонов. Реакции окисления и восстановленияСтраница 1
Химические свойства альдегидов и кетонов
Двойная связь С=О, подобно связи С=С, представляет собой комбинацию s - и p-связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6. ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом p-связь поляризована сильнее, чем s-связь. Таким образом, атом углерода карбонильной группы является электронодефицитным центром, а кислорода - электроноизбыточным.
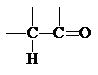 |
d+ d-
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за - I-эффекта карбонильной группы) и термодинамической кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центоров.
Электрофильный центр - карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Основный центр - атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. Важно отметить, что альдегиды и кетоны являются жесткими основаниями Льюиса и координируются с жесткими кислотами: H+, BF3, ZnCl2, FeCl3 и т.д.
a-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации.
Связь С¾Н в альдегидной группе разрывается в реакциях окисления.
Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
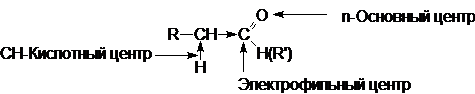
Реакции окисления и восстановления
Реакции окисления.
По отношению к различным окислителям свойства альдегидов и кетонов сильно различаются. Большинство окислителей, включая воздух, легко окисляют альдегиды до кислот. Особенно легко окисляются ароматические альдегиды.
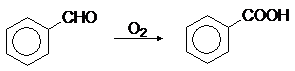 (75)
(75)
Реакция проходит по радикальному механизму через образование гидроперекисей. Для сохранения альдегидов от окисления атмосферным воздухом к ним прибавляют небольшие количества антиоксидантов, блокирующих свободные радикалы. В качестве антиоксидантов используют ароматические амины и фенолы.
![]() (76)
(76)
гексаналь гексановая кислота
А. Реакция серебряного зеркала
Легкая окисляемость альдегидов используется для их качественного определения. Окисление альдегидов с помощью растворов, содержащих двухвалентную медь (реактив Фелинга) или серебро (реактив Толленса) является тестом на присутствие альдегида.
![]()
В технике эта реакция используется для серебрения зеркал и игрушек:
![]() (77)
(77)
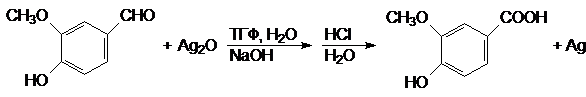 (78)
(78)
ванилин ванилиновая кислота
Б. Окисление кетонов
Кетоны значительно более устойчивы к окислению, чем альдегиды, т. к. рядом с карбонильной группой у них нет атома водорода. Кетоны не восстанавливают ни реактив Фелинга ни реактив Толленса. Сильные окислители, такие как перманганат калия и азотная кислота окисляют кетоны
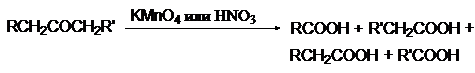 |
Смотрите также
Источники поступления
В отраслях
промышленности – основными загрязнителями окружающей среды являются:
электроэнергетика – 0,2%, цветная металлургия – 3%, химические и
нефтепромышленные предприятия – 5%, машиностроение и ...
Введение
Процессы ректификации являются одними из самых энергоемких
процессов химической технологии, и их эффективность часто определяет экономику
производства в целом. В ряде случаев на разделение методом р ...
Технология производства эпоксидных смол
Производство
эпоксидных смол началось с исследований проводимых в США и Европе накануне
второй мировой войны. Первые смолы — продукты реакции эпихлоргидрина с
бисфенолом А — были получены в ...


