Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические свойства.Учим химию / Характеристика химического элемента №16 (Сера) / Учим химию / Характеристика химического элемента №16 (Сера) /
Химические свойства.
Химические свойства.Страница 1
Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:
 В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
![]()
 С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для
удаления разлитой ртути, пары которой являются сильным ядом.(3)
Несколько примеров соединений серы.
При нагревании серы с водородом происходит обратимая реакция:
![]()
 с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот
с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот
 Эту реакцию часто проводят в аппарате Киппа.
Эту реакцию часто проводят в аппарате Киппа.
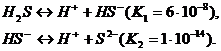 |
 Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
 но и более слабыми, например сернистой кислотой H2SO3:
но и более слабыми, например сернистой кислотой H2SO3:

 Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропуская
сероводород через соли соответствующего металла, например:

Некоторые сульфиды имеют характерную окраску: CuS
и PbS
— черную, CdS
— желтую, ZnS
— белую, MnS
— розовую, SnS— коричневую, Sb2S3
— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.(4)
Оксид серы (IV).
Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
Смотрите также
Производство этилового спирта
Этиловый спирт находит широкое применение в народном хозяйстве в
качестве растворителя, также применяется в производстве дивинила, в пищевой и
медицинской промышленности, в качестве горючего ...
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...


