Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Вторичная структураУчим химию / Характеристика белков / Учим химию / Характеристика белков / Вторичная структура Вторичная структура
Вторичной структурой называют конформацию, которую образует полипептидная цепь. Для высокомолекулярных белков характерна структура спирали.
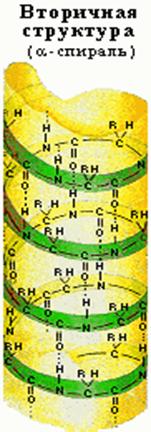 Впервые такая структура на основе рентгеноструктурного анализа была обнаружена при изучении главного белка волос и шерсти -a- кератина (Л. Полинг). Ее назвали a-структурой или a-спиралью. Обычно в природных продуктах встречаются белки со строением правой спирали, хотя известна и структура левой спирали.
Впервые такая структура на основе рентгеноструктурного анализа была обнаружена при изучении главного белка волос и шерсти -a- кератина (Л. Полинг). Ее назвали a-структурой или a-спиралью. Обычно в природных продуктах встречаются белки со строением правой спирали, хотя известна и структура левой спирали.
Спиральные структуры белка.
Для полипептидных цепей известно несколько различных типов спиралей. Если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, то спираль считается правой (правозакрученной), а если удаляется против часовой стрелки — левой (левозакрученной). Наиболее распространена правая a-спираль (предложена Л. Полингом и Р. Кори). Идеальная a-спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6. строение спирали стабилизируется внутримолекулярными водородными связями.
В природных белках существуют лишь правозакрученные a-спиральные конформации полипептидных цепей, что сопряжено с наличием в белковых телах аминокислот только L-ряда (за исключением особых случаев).
При растяжении a-кератина образуется вещество с другими свойствами - b-кератин. При растяжении спираль макромолекулы белка превращается в другую структуру , напоминающую линейную. Отдельные полипептидные цепи здесь связаны межмолекулярными водородными связями. Эта структура называется b-структурой ( структура складчатого листа, складчатого слоя)
Складчатые структуры белка.
Одним из распространенных примеров складчатой периодической структуры белка являются так называемые b-складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом.
b-складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга.
Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию b-складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической.
Возникновение a- и b-структур в белковой молекуле является следствием того, что аминокислоты и в составе полипептидных цепей сохраняют присущую им способность к образованию водородных связей. Таким образом, крайне важное свойство аминокислот — соединяться друг с другом водородными связями в процессе образования кристаллических препаратов — реализуется в виде a-спиральной конформации или b-структуры в белковой молекуле. Следовательно, возникновение указанных структур допустимо рассматривать как процесс кристаллизации участков полипептидной цепи в пределах одной и той же белковой молекулы.
Смотрите также
Алкалоиды и история их открытия
...
Кремнийорганические полимеры
Полимером
называется органическое вещество, длинные молекулы которого построены из
одинаковых многократно повторяющихся звеньев - мономеров.
Размер молекулы
полимера определяется степень ...


