Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Оксид фосфора (V)Учим химию / Фосфор и его соединения / Учим химию / Фосфор и его соединения / Оксид фосфора (V) Оксид фосфора (V)
|
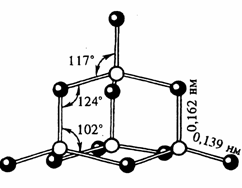
Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора. |
|
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t0пл.= 5700С, t0кип.= 6000C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 ® 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O ®2HPO3 (метафосфорная кислота)
P2O5 + 2H2O ® H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O ® 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO ® Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
![]()
![]() гидрофосфат натрия
гидрофосфат натрия
![]() дигидрофосфат натрия
дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
![]()
Смотрите также
Висмут и его соединения в природе
Среди элементов периодической системы висмут – последний практически не радиоактивный элемент,
И он же открывает шеренгу тяжелых элементов – естественных альфа-излучателей. Действительно, тот ...
Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева
...
Использование озона
Озон -
высокоэффективное и универсальное окисляющее вещество, которое используется в
обработке воды в целях дезинфекции, удаления марганца и железа, улучшения
вкуса, устранения цвета и запа ...