Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет теплового эффекта реакцииУчим химию / Физическая химия / Учим химию / Физическая химия / Расчет теплового эффекта реакции Расчет теплового эффекта реакцииСтраница 1
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
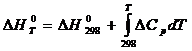 (1)
(1)
где: ∆Н0298 – стандартный тепловой эффект реакции при 298 К;
∆СР - изменение теплоемкости системы в результате протекания реакции.
Последняя величина рассчитывается по уравнению:
![]() (2)
(2)
где Ср,i – мольная изобарная теплоемкость i-го вещества;
ni – стехиометрический коэффициент i-го вещества в уравнении реакции (1).
После подстановки зависимостей Ср,i в выражение (2), оно имеет вид
∆Ср,i = ∆а + ∆bТ + ∆с/Т-2 (3)
где ![]() (4)
(4)
∆b и ∆с/ рассчитываются аналогично.
∆а = а(н2о) + а(cos) – (а(н2s) + a(co2)) = 30,00+48,12-(44,14+29,31) =
= 78,12 – 73,51 = 4,61 Дж/моль∙К
∆b = b(н2о) + b(cos) – (b(н2s) + b(co2)) =
= 8,45∙10-3 +10,71∙10-3 – (9,04∙10-3 + 15,40∙10-3) = -5,28∙10-3
∆сi = с/(н2о) + с/ (cos) – с/ (co2) = -8,20∙105 + 0,33∙105 + 8,54∙105 = 0,67∙105
Значение ∆Н0298 определяется по стандартным теплотам образования ∆Н0298,i:
![]() (5)
(5)
Значения теплот образования соответствующих веществ приведены в табл. 1. После их подстановки в уравнение (5) имеем
∆Н0298 = -141,70 - 241,81 – (-393,51 – 20,60) = -383,51+417,11 = 33,6 кДж =
= 33600 Дж
В соответствии с заданием необходимо рассчитать тепловые эффекты в интервале температур 800 – 1700 К при шаге температуры 100 К. После подстановки значений ∆Ср из уравнения (3) в (1) получим тепловые эффекты:
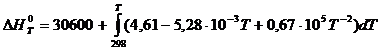
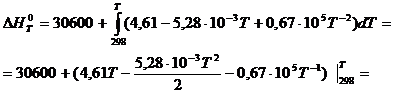
= 30600+((4,61Т - 2,64∙10-3 Т2 – 0,67∙105 Т-1)-(1373,78 - 243,44 – 224,83)) =
=(30600 - 905,51) + 4,61Т – 0,67∙105 Т-1 – 2,64∙10-3Т2
∆Н0т = 4,61Т – 0,67∙105Т-1 – 2,64∙10-3Т2 + 29694,49
∆Н0800 = 4,61∙800 – 0,67∙105/800 – 2,64∙10-38002 + 29694,49 =
= 3688 – 83,75 – 1689,6 + 29694,49 = 31609,15 Дж
……………………………………………………………………….
∆Н01700 = 4,61∙1700 – 0,67∙105/1700 – 2,64∙10-3∙17002 + 29694,49 = 29862,48 Дж
Значения тепловых эффектов приведем в табл. 2.
Таблица 2.
Величина ∆Н0т при различных температурах для
реакции H2S + CO2= H2O + COS
|
Т, К |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
1600 |
1700 |
|
∆Н0т, Дж |
31609 |
31631 |
31597 |
31510 |
31369 |
31174 |
30926 |
30625 |
30270 |
29862 |
Смотрите также
Задание
1.
Уравнение реакции
Br Br
...
Токсические химические элементы. Химизм действия
Число
публикаций о токсичности неорганических соединений весьма велико. Наиболее
интенсивно изучаются соединения переходных элементов (тяжелых металлов) в связи
с их непрерывно расширяющимс ...
Принципы определения примесей арсена в неизвестном минерале
В условиях активного загрязнения окружающей
среды и реальности экологического кризиса возрастает значение научных
исследований, направленных на изучение состояния экосистемы, и практического ...


