Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ВведениеСтраница 1
Нижеследующий реферат будет посвящен различным видам физической связи (ван-дер-ваальсовой и водородной) и их связи с физическими и химическими свойствами веществ. В отличие от химической связи (ковалентная, донорно-акцепторная, ионная) водородная и ван-дер-ваальсовая связи, как правило, не на столько сильны. Однако они оказывают значительное влияние на многие физические свойства веществ (теплота испарения жидкости либо теплота возгонки кристалла, температуры плавления и кипения). А также на количественные характеристики некоторых химических реакций: такие как тепловой эффект и энергия активации (температура активации либо минимальная для активизации реакции частота излучения) образования и диссоциации молекулярных комплексов, молекул и сложных ионов. Именно ван-дер-ваальсовые и водородные взаимодействия являются причиной как коагуляции коллоидных растворов так и их устойчивости, а также физической основой абсорбции и адсорбции, что уже сейчас применяется при проектировании очистных сооружений.
Молекулы, валентно насыщенные в обычном понимании (такие как CO2, H2O, I2, Ne и др.), взаимодействуют между собой, о чем свидетельствует конденсация реальных газов (идеальный газ не конденсируется ни при каких условиях). Силы, действующие между молекулами газа и вызывающие отклонение газов от идеальности, называют силами Ван-дер-Ваальса, по имени ученого, который впервые учел взаимное притяжение и отталкивание молекул при выводе уравнения состояния реальных газов.
Как известно, все химические вещества состоят из молекул в свою очередь состоящих из электрически заряженных частиц, электронов и атомных ядер. Вследствие того, что в молекуле положительные и отрицательные заряды разделены и постоянно находятся в относительном движении, в каждый момент времени подавляющее большинство молекул находятся в виде электрических диполей. Взаимодействие возникших вследствие тех или иных причин дипольных моментов молекул и называется связью Ван-дер-Ваальса. В зависимости от происхождения дипольного момента взаимодействующих молекул ван-дер-ваальсового притяжения разделяют на ориентационные, индукционные и дисперсионные. Притяжение между молекулами принимает существенные значения уже на довольно больших расстояниях (~10Å); однако же, взаимодействие Ван-дер-Ваальса включает эффекты не только притяжения, но и отталкивания, эти силы играют в нашей жизни не менее важную роль т.к. не позволяют всем молекулам слипнуться в единый материальный ком, в гигантскую глобулу.
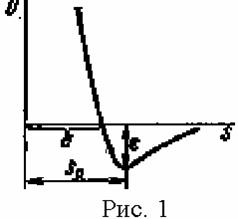 То, что плотности жидкостей и кристаллов имеют вполне конечную величину, указывает на одновременное существование отталкивания между молекулами; не будь отталкивания, молекулы при сближении сливались бы в одно целое и плотность возрастала бы практически не ограниченно. В конденсированном состоянии (жидкости или кристалле), построенном из молекул, притяжение сближает частицы до расстояния, на котором силы притяжения и отталкивания равны по величине. Потенциальная кривая взаимодействия двух молекул приведена на рис.1; от потенциальной кривой двухатомной молекулы она отличается лишь количественно: глубина потенциальной ямы, т.е. энергия взаимодействия, значительно меньше, а равновесное расстояние s0- больше. Таким образом, различие между химическими и межмолекулярными (ван-дер-ваальсовыми и водородными) связями в первую очередь - количественное. Природа же сил в обоих случаях - одна и та же - электрическая. Расстояние между молекулами в жидкостях и кристаллах ~3-5Å, а энергия взаимодействия ~1-5 кДж/моль для сил Ван-дер-Ваальса, что в 100 раз меньше энергии химической связи (водородные связи как по энергии, так и по длинне связи примыкают как к ван-дер-ваальсовым, так и к химическим связям практически вплотную). Для определения энергии межмолекулярной связи e определяют энергию сублимации (либо испарения) l и вычитают из нее работу изобарного расширения; e=l-p(Vг-Vж)»l-pVг»l-RT.
То, что плотности жидкостей и кристаллов имеют вполне конечную величину, указывает на одновременное существование отталкивания между молекулами; не будь отталкивания, молекулы при сближении сливались бы в одно целое и плотность возрастала бы практически не ограниченно. В конденсированном состоянии (жидкости или кристалле), построенном из молекул, притяжение сближает частицы до расстояния, на котором силы притяжения и отталкивания равны по величине. Потенциальная кривая взаимодействия двух молекул приведена на рис.1; от потенциальной кривой двухатомной молекулы она отличается лишь количественно: глубина потенциальной ямы, т.е. энергия взаимодействия, значительно меньше, а равновесное расстояние s0- больше. Таким образом, различие между химическими и межмолекулярными (ван-дер-ваальсовыми и водородными) связями в первую очередь - количественное. Природа же сил в обоих случаях - одна и та же - электрическая. Расстояние между молекулами в жидкостях и кристаллах ~3-5Å, а энергия взаимодействия ~1-5 кДж/моль для сил Ван-дер-Ваальса, что в 100 раз меньше энергии химической связи (водородные связи как по энергии, так и по длинне связи примыкают как к ван-дер-ваальсовым, так и к химическим связям практически вплотную). Для определения энергии межмолекулярной связи e определяют энергию сублимации (либо испарения) l и вычитают из нее работу изобарного расширения; e=l-p(Vг-Vж)»l-pVг»l-RT.
Смотрите также
Получение уксусной кислоты
...
Физическая связь
...
Фосфор и его соединения
Пятая группа Периодической системы включает два типических элемента азот
и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими
элементами наблюдается значительное раз ...


