Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение катализаБиблиотека / Реакция катализа и промышленные катализаторы / Библиотека / Реакция катализа и промышленные катализаторы / Определение катализа Определение катализа
Катализ – это ускорение одного или нескольких возможных направлений превращения химических веществ.
Термодинамика дает ответ на вопрос, как далеко может пройти конкретная химическая реакция. Этот ответ не зависит от пути реакции. На вопрос, с какой скоростью будет достигаться это конечное состояние, отвечает кинетика.
Скорость зависит от пути реакции!
Например, смесь 1,5 % бутана с воздухом при бесконечном по времени их контакте при температуре 4500 С превратится в смесь диоксида углерода, воды и остатка воздуха. В присутствии катализатора, состоящего из смеси V, P и O, в течение 2-3 секунд примерно половина бутан окислится в малеиновый ангидрид.
Катализаторы ускоряют один или несколько термодинамически возможных превращений участников реакции, создавая, как правило, новый, энергетически более выгодный путь.
СН3---СН2---СН2--- СН3 + 3,5 О2 ==
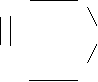 HC C ==O
HC C ==O
O
HC C ==O
Новый путь появляется за счет того, что реагенты образуют химические (промежуточные) соединения с катализатором.
Смотрите также
Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова
данные [25, 26] показывают, что в системах KI - PdI2 –
фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются
развитые релаксацио ...
Химическая связь и строение молекул.
Свойства вещества определяются его химическим
составом, порядком соединения в молекулу атомов и их взаимным влиянием. Теория
строения атомов объясняет механизм образования молекул и природу химическ ...
Характеристика кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого
Kobold - домовой, гном. Соединения кобальта были известны и применялись в
глубокой древности. Сохранился египетский с ...


