Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Взаимодействие a-литиированных
альдонитронов с С-электрофилами. Взаимодействие
с a,b-ненасыщенными карбонильными соединениями.Библиотека / Реакции a-литиированных циклических нитронов с электрофильными реагентами / Библиотека / Реакции a-литиированных циклических нитронов с электрофильными реагентами / Взаимодействие a-литиированных
альдонитронов с С-электрофилами. Взаимодействие
с a,b-ненасыщенными карбонильными соединениями. Взаимодействие a-литиированных
альдонитронов с С-электрофилами. Взаимодействие
с a,b-ненасыщенными карбонильными соединениями.Страница 1
Ранее было показано,10 что литиирование циклических альдонитронов и последующая реакция с карбонильными соединениями приводит к продуктам присоединения по карбонильной группе. В реакцию были введены алифатические, ароматические, и гетероциклические альдегиды и кетоны.
В литературе описан единственный пример реакции a-литиированного производного альдонитрона ряда 3-имидазолин-3-оксида с a,b-ненасыщенным карбонильным соединением – метилвинилкетоном.10
В данной работе нами было исследовано взаимодействие a-литиированных производных циклических альдонитронов с различными a,b-ненасыщенными карбонильными соединениями.
Так при взаимодействии литиированного производного альдонитрона 58
с окисью мезитила из реакционной смеси с выходом 92 % был выделен маслообразный продукт. В спектре ЯМР 1Н полученного соединения наряду с сигналами протонов 8 метильных групп, наблюдается характерный сигнал винильного атома водорода при 5.14 м.д. и атома водорода ОН
группы при 7.85 м.д На основании полученных спектральных данных и данных элементного анализа полученному соединению была приписана структура 2-(1,2,2,5,5-пентаметил-3-имидазолин-3-оксид-4-ил)-бут-3-ен-2-ола 63
.
.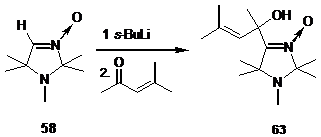
Аналогичное взаимодействие в указанных выше условиях альдонитрона 59
- производного пирролин-1-оксида с окисью мезитила приводит к образованию 2-(2,2,4,4-тетраметилпирролин-1-оксид-2-ил)-бут-3-ен-2-ола 64
с выходом 83%.
Литиирование альдонитрона 58
s-BuLi при -70 0С и последующая обработка раствором кумарина в диэтиловом эфире приводит к образованию соединения с ярко выраженной кислотной природой: продукт реакции не удалось проэкстрагировать из водной фазы при pH ” 10-11, образующейся при разложении реакционной среды водой. Подкисление реакционной среды уксусной кислотой до pH ” 3 приводит к изменению цвета реакционной смеси с интенсивного малинового до жёлтого. Экстракция из подкисленного раствора и последующая отгонка растворителя позволяет получить хроматографически чистый продукт жёлтого цвета.
В ик-спектре полученного соединения, записанного в растворе СНCl3, наблюдается полоса при 3254 см-1, отнесённая к валентным колебаниям ОН
группы,
а также полосы колебаний при 1576, 1597, 1612 и 1640 см-1. Поскольку эта область характерна для валентных колебаний карбонильной группы, сопряженной с кратной связью, валентных колебаний нитронной группы и С=С связей ароматического кольца, однозначное отнесение полос колебаний затруднено.
В спектре ЯМР 1Н полученного соединения, наряду с сигналами протонов геминальных метильных групп имидазолинового цикла и группы N-CH
3 при 1.4, 1.5 и 2.4 м.д. соответственно, наблюдаются сигналы ароматических протонов в областях 7.6 – 7.9 м.д. и 7.1-7.5 м.д. Мультиплет с центром при 8.00 м.д., представляющий собой АВ-систему, был отнесен к резонансу протонов фрагмента H
-C=C-H
, а уширенный сигнал в области 7.6-7.8 м.д. был отнесён к резонансу протона ОН
-группы.
На основании полученных спектральных данных и данных элементного анализа полученному соединению была приписана структура 3-(2-гидроксифенил)-1-(1,2,2,5,5-пентаметил-3-имидазолин-3-оксид-4-ил)-пропенона 65
. Таким образом, реакция с кумарином проходит по типу 1,2-нуклеофильного присоединения по карбонильной группе.
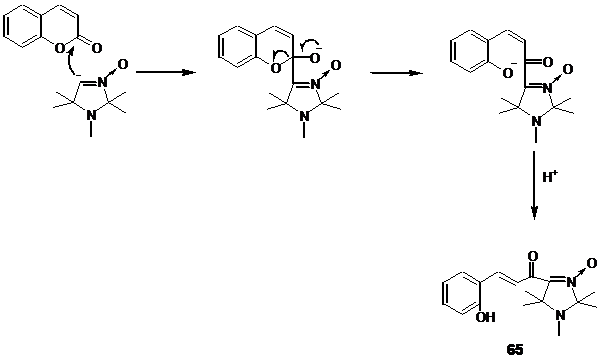
В спектре ЯМР 13С полученного соединения наблюдается, в частности, характерный сигналы при 182.22 м.д., отнесённый к резонансу атома углерода карбонильной группы, сигнал фенольного атома углерода при 157.35 м.д. и сигнал при 141.65 м.д. атома углерода нитронной группы. Отнесение сигналов атомов углерода ароматической системы и двойной связи было сделано на основании сравнения спектра со спектром ЯМР 13С 4-(2 гидроксифенил)-3-бутен-2-она 66
.
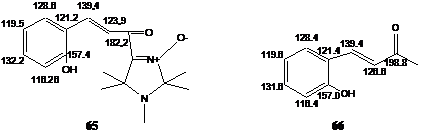
в спектре ЯМР 1Н полученного соединения наблюдается спин-спиновое взаимодействие протонов группы Н-С=С-Н с константой ССВ 16 Гц. Такая величина константы ССВ характерна для группы Н
-С=С-Н
с транс-расположением атомов водорода,[xxxvii] и, следовательно, в полученном соединении заместители находятся в транс-положении относительно двойной связи. Константа ССВ для цис-a,b-ненасыщенных карбонильных соединений, например, для кумарина, составляет 12 Гц.[xxxviii] Наличие полосы колебаний в ИК спектре при 977 см-1, характерной для соединений с транс-расположением атомов водорода при двойной связи, также свидетельствует о транс-конфигурации двойной связи в полученном соединении 65
Смотрите также
Cложные эфиры
...
Получение препаратов протеиназы penicillium wortmannii 2091 и
исследование их физико-химических свойств.
Известно, что
микроорганизмы синтезируют богатые набором ферментов комплексы. Поэтому важным
этапом в получении препаратов направленного действия является изучение условий
их выделения, очистки от ...
Методы выделения и анализа кумаринов в лекарственное растительное сырьё
Физиологическая роль кумаринов до конца не установлена. Известно, что они
участвуют в регуляции роста растений, являясь антагонистами ауксинов; поглощают
ультрафиолетовые лучи, защищая молод ...


