Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Соединения ниобияБиблиотека / Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева / Ниобий / Библиотека / Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева / Ниобий / Соединения ниобия Соединения ниобияСтраница 1
Рассказ об элементе был бы не полным без упоминания о его соединениях с галогенами, карбидами и нитридами. Это важно по двум причинам. Во-первых, благодаря фторидным комплексам удается отделить ниобий от его вечного спутника тантала. Во-вторых, эти соединения приоткрывают нам качества ниобия как металла.
Взаимодействие галогенов с металлическим ниобием:
2Nb + 5Cl2 = 2NbCl5 могут быть получены, все возможные пентагалогениды ниобия.
Пентафторид NbF5 (tпл = 76 °С) в жидком состоянии и в парах бесцветен. Подобно пятифтористому ванадию, в жидком состоянии он полимерен. Атомы ниобия соединены друг с другом через атомы фтора. В твердом виде имеет структуру, состоящую из четырех молекул (рис. 2).
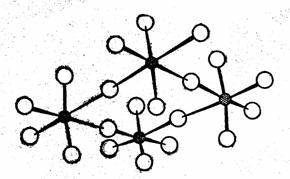
Рис. 2. Структура NbF5 и TaF5 в твердом виде состоит из четырех молекул.
Растворы в фтористоводбродной кислоте H2F2 содержат различные комплексные ионы:
NbF5 + H2F2 = Н2 [NbF7] ;
NbF5 + H2O = H2[NbOF5]
Калиевая соль K2[NbOF5] . H2O важна для отделения ниобия от тантала, так как в отличие от соли тантала она хорошо растворима.
Остальные пентагалогениды ниобия ярко окрашены: NbCl5 желтый, NbBr5 пурпурно-красный, NbI2 коричневый. Все они возгоняются без разложения в атмосфере соответствующего галогена; в паре они мономеры. Температуры их плавления и кипения возрастают при переходе от хлора к брому и иоду. Некоторые из способов получения пентагалогенидов таковы:
2Nb+5I2![]() 2NbI5;
2NbI5;
Nb2O5+5C+5Cl2![]() 2NbCl5+5CO;.
2NbCl5+5CO;.
2NbCl5+5F2![]() 2NbF5+5Cl2
2NbF5+5Cl2
Пентагалогениды хорошо растворяются в органических растворителях: эфире, хлороформе, спирте. Водой, однако, полностью разлагаются -гидролизуются. В результате гидролиза получаются две кислоты -галогеноводородная и ниобиевая. Например,
NbCl5 + 4H2О = 5HCl + H3NbО4
Когда гидролиз нежелателен, то вводят какую-либо сильную кислоту и равновесие написанного выше процесса смещается в сторону NbCl5. В таком случае пентагалогенид растворяется, не подвергаясь гидролизу,
Особую признательность у металлургов заслужил карбид ниобия. В любой стали, есть углерод; ниобий, связывая его в карбид, повышает качества легированной стали. Обычно при сварке нержавеющей стали, шов имеет меньшую прочность. Введение ниобия в количестве 200 г на тонну помогает исправить этот недостаток. При нагревании ниобий раньше всех других металлов стали образует соединение с углеродом - карбид. Это соединение достаточно пластичное и в то же время способно выдерживать температуру до 3500°
С.
Слоя карбида толщиной всего в полмиллиметра достаточно, чтобы оградить от коррозии металлы и, что особенно ценно, графит. Карбид может получаться при нагревании металла или оксид ниобия (V) с углеродом или углеродсодержащими газами (СН4, СО).
Нитрид ниобия - соединение, на которое не действуют никакие кислоты и даже «царская водка» при кипячении; устойчив по отношению к воде. Единственное, с чем его можно заставить вступить во взаимодействие, - кипящая щелочь. В этом случае он разлагается с выделением аммиака.
Смотрите также
Деформируемые алюминиевые сплавы
Металловедение – наука,. Изучающая строение
и свойства металлов и устанавливающая связь между их составом, строением и
свойствами.
В данном реферате приведены общие и
теоретические сведе ...
Жизнь и научные открытия А.Л. Лавуазье и К.Л. Бертолле
Лавуазье и Бертолле – без сомнения, самые выдающиеся
ученые-химики своего времени. И по праву считаются основателями современной
химии, создателями принятой ныне химической номенклатуры.
...
Общие свойства молекулярных орбиталей
Общие
свойства МО хюккелевских УВ:
Альтернантность.
Теорема парности.
Свойства
корней векового детерминанта.
Матрица
коэффициентов (составы МО).
Свойства
коэффициентов.
П ...


