Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Энергетический барьерБиблиотека / Процесс катализа / Библиотека / Процесс катализа / Энергетический барьер Энергетический барьер
Все каталитические реакции - самопроизвольный процесс, т.е. протекают в направлении убыли энергии Гиббса - убыли энергии системы.
Давно уже было известно, что молекулы неионогены вступают в реакцию гораздо реже, чем сталкиваются друг с другом. Аррениус объяснил этот факт, предположив, что молекулы могут реагировать лишь в том случае, если в момент столкновения они обладают запасом энергии не ниже некоторой критической величины. В этом случае они называются “активными молекулами”.
А. Резчик, 1945 г.
Такая теория существует, это теория абсолютных скоростей реакций, начало которой было положено теоретическими исследованиями Поляни в 1931 г. Ниже мы с ней познакомимся, а пока обратим внимание еще на один закон химической кинетики, известный под названием закона Аррениуса (1889). Закон связывает константу скорости реакции с некоторой характерной для данной реакции энергетической характеристикой, называемой энергией активации Е.
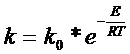
![]() (26)
(26)
где k0 - константа, или предэкспоненциальный множитель; R - газовая постоянная, равная 1,987 кал/град*моль', Т - температура в градусах шкалы Кельвина; е - основание натуральных логарифмов.
Чтобы найти величину энергии активации Е, изучают скорость реакции при разной температуре и находят для каждого значения Т величину константы скорости. Поскольку уравнение (26) содержит две неизвестные величины - k0 и Е, то поступают следующим образом. Логарифмируют (26)
+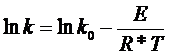 (27)
(27)
строят график зависимости Ln(k) от 1/Т и определяют угловой коэффициент, который равен Е/R. Обычно используют не натуральные, а десятичные логарифмы .
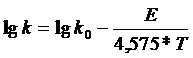
(28)
(Последнее число - модуль перевода натуральных логарифмов в десятичные, умноженный на величину R = l.987.)
С законом Аррениуса связано широко распространенное в химии символическое изображение пути реакции в виде энергетической диаграммы, показанной на рис. 1. Смысл этого изображения таков: для того чтобы молекулы перешли из одного состояния H1 в другое H2, они должны обладать запасом внутренней энергии, не меньшим некоторого критического значения Е. Состояния Hl и Н2 разделены, таким образом, некоторым энергетическим барьером с высотой, равной энергии активации Е, и чем ниже высота барьера, тем больше скорость реакции в соответствии с уравнением Аррениуса. Это возрастание не беспредельно: даже при отсутствии барьера (Е = О) реакция будет протекать с некоторой конечной (а не бесконечно большой) скоростью, так как при Е=0 одновременно
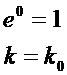 .
.
Важным свойством энергетической диаграммы является то, что исходный H1 и конечный Н2, уровни не зависят от высоты барьера. Можно произвольно менять высоту барьера Е (если, конечно, мы знаем, как это сделать практически), но при этом уровни H1 и Н2 останутся без изменения, если заданы определенные внешние условия - температура, давление и т. п. Иначе говоря, существуют в принципе различные пути, по которым могут перемещаться молекулы из одного фиксированного состояния в другое, в том числе и такие, на которых энергетический барьер равен нулю; не может быть только такого случая, когда Е < О.
Смотрите также
Физико-химические свойства меди и железа
...
Вычисление теплового эффекта реакций
Вычислить тепловой эффект реакции при стандартных
условиях: Fe2O3 (т) + 3 CO (г)
= 2 Fe (т) + 3 CO2 (г),если теплота образования: Fe2O3
(т) = – 821,3 кДж/моль;СО(г) = – 110,5 кДж/моль;
...
Органические красители
Понятие
«красящее вещество» подразумевает возможность окрашивания любого субстрата. #
хранения волокон, подкрашивание пищевых продуктов (пищевые пасты, сливочное
масло и т.д.) все окрашенны ...


